1 生体
1)患者
(1)注射部位の皮膚
注射部位から感染を起こすことはまれであるが、注射部位の皮膚が高度に汚染されている場合や易感染患者の場合には十分な注意が必要である。また、血液培養の採血を行う際には、コンタミネーションを防止するため、十分な消毒が必要である。
注射部位の消毒には速効性と速乾性が求められるため、アルコール製剤を用いることが多い。10%ポビドンヨード液1)や10%ポビドンヨードエタノール液などを用いることもできるが、これらは皮膚を着色し、水溶液は乾燥までに時間を要する。消毒効果を確保するためには、消毒用エタノール、70%イソプロパノール、イソプロパノール添加エタノール液などを十分量塗布し、乾燥するまで接触時間をとる。感染を防ぐため、周辺皮膚も消毒し、刺入部を素手で触れないように注意する。処置をごく短時間で済ませるために、固く絞ったアルコール綿球で注射部位を強く擦る場合も見られるが、このような処置では皮膚表面の汚れを落とす効果が期待されるに過ぎない。
アルコール綿などはあらかじめ万能壷などに調製される場合があり、万能壷内にアルコールが十分量入っていれば約1週間は継続使用が可能である。ただし経時的にアルコールと水分が蒸発することやアルコール濃度が低下することに注意が必要であり、定期的に廃棄の上、調製し直す必要がある2)。アルコールや綿を注ぎ足して再調製すること、汚染された手を壷の中に入れること、壷の中でアルコール綿を指で絞ることなどは避けるべきである。近年はあらかじめ調製されたアルコール綿が市販されており、単包あるいは複数枚入りパック製品が存在する。これらを使用することで業務を合理化することができる。
血液培養の採血時の皮膚消毒について、ヨードチンキは10%ポビドンヨード液と比較して有意に血液培養時の汚染率が低いと評価されている2つの報告3、4)がある一方で、両者の消毒薬に加えて70%イソプロパノールやポビドンヨードアルコールの4つの消毒薬の間に有意差はなかったとの報告5)もある。また、クロルヘキシジンアルコールと10%ポビドンヨード液の比較においてはクロルヘキシジンアルコールの方が有意に血液培養時の汚染率が低いと評価された2つの報告6、7)がある。クロルヘキシジンアルコールとヨードチンキの比較では、2つの報告において両者に有意差は認められなかったと評価されている8、9)。このように血液培養の採血時の皮膚消毒には様々な消毒薬についての研究がある。
国内では血液培養の採血時の皮膚消毒には10%ポビドンヨード液が一般的に使用されているが、最近のメタアナリシスによる研究10)では10%ポビドンヨード液よりクロルヘキシジンアルコールの方が血液培養の汚染リスクが67%減少(相対リスク0.33)すると評価されている。米国感染症学会のガイドライン(2009年)11)では血液培養時の皮膚消毒にポビドンヨードよりもアルコール、ヨードチンキまたは0.5%を超えるクロルヘキシジンを配合したアルコール製剤の使用を推奨しており、これらの消毒薬はポビドンヨードより適切な皮膚への接触時間・乾燥時間を担保でき、血液培養時の汚染を軽減することが認められると述べられている。英国保健省が公表している英国版のケア・バンドル12)においては2%クロルヘキシジン70%イソプロパノールの使用を推奨している。
【注射部位の皮膚の消毒】
●消毒用エタノール
●70%イソプロパノール
●イソプロパノール添加エタノール液
(2)血管内留置カテーテル挿入部位の皮膚13~17)
医療関連感染である血流感染の多くは血管内留置カテーテルに関連している。特に中心静脈カテーテル(CVC)に関連した血流感染、また、小児の血管内留置カテーテルに関連した血流感染の発生率は高率であり、重大な医療関連感染のひとつとして対策を講じる必要がある。
①血管内留置カテーテル関連感染起因菌の侵入経路
血管内留置カテーテルに関連した感染の起因菌侵入経路には以下の3つが考えられる。
〈血管内留置カテーテル挿入部位からの侵入〉
カテーテル挿入時の皮膚消毒や無菌テクニックなど不適切な挿入手技によって血管内に微生物が進入する経路である。また、血管内留置カテーテル挿入部位の皮膚に存在する常在菌や医療従事者の手指などから伝播した通過菌が、血管内留置カテーテルの外壁を伝わって血管内に侵入する経路もあり、最も重要な侵入経路である。この経路を遮断するためには消毒薬の適用を含むカテーテル挿入部位のケアが重要である。このケアの方法に関しては、後に述べる。
〈ルート接合部からの侵入〉
輸液と血管内留置カテーテルを結ぶルートには、輸液ボトルゴム栓への針挿入部、三方活栓、ハブなど様々な接合部がある。これらの接合部が医療従事者の手指などにより微生物汚染を受けて、輸液ルート内に微生物が侵入する場合もあるので、医療従事者によるルート操作前の衛生的手洗い、接合部の無菌的操作法を徹底する必要がある。また、接合部の消毒も重要であるが、この目的で実際に用いられている消毒薬としては、10%ポビドンヨード液、0.5%クロルヘキシジンエタノール液、消毒用エタノール、70%イソプロパノールなどを挙げることができるが、日本における勧告は消毒用エタノールまたは70%イソプロパノールの使用を薦めている15)。アルコールは速乾性であり残留薬物がないため、操作性、安全性の面からも望ましい。
〈輸液自体の汚染〉
市販の輸液は無菌であることが保証されているが、病院内における様々な混注操作を経て、輸液自身が微生物汚染を受けることがある。輸液の混注操作は薬剤部により無菌的に行うことが望ましい。ルート維持のためにヘパリンロックを行う場合には、同一容器のヘパリン生食を多数回、多数の患者に使用することは、集団感染の原因となるため避けるべきである。一般に注射剤は単回使用を原則とし、やむなく多数回使用する場合には厳密な無菌操作法を遵守しなければ感染発生の危険性が高いことに十分注意するべきである。なお、あらかじめ単回使用分が注射筒に充填されたプレフィルドタイプの市販品を使用すると安全である。
②血管内留置カテーテル挿入部位の消毒
血管内留置カテーテルの挿入は、末梢血管への挿入であっても、通常の注射等に比べて侵襲性が高く、侵襲期間も長いため、挿入部位の念入りな消毒を行うことが肝要である。特に、中心静脈カテーテルの挿入時には手術部位の消毒に準じた消毒を挿入部位に行う必要があり、また、挿入操作前に厳重な手洗いを行い、滅菌手袋を着用の上、滅菌ガウン着用などのマキシマルバリアプリコーションを行い、なるべくクリーンな環境において挿入することが望ましい。
挿入部位の消毒に用いる消毒薬として日本で繁用されているのは、10%ポビドンヨード液であるが、日本における勧告はクロルヘキシジンアルコール、70%イソプロパノール、消毒用エタノール、10%ポビドンヨード液、またはヨードチンキの使用を薦めている15)。
CDC「血管内カテーテル関連感染の予防のためのガイドライン(2011年)」18、19)では中心静脈カテーテルや末梢動脈カテーテル挿入前およびドレッシング交換時の皮膚消毒にクロルヘキシジン濃度が0.5%を超える(>0.5%)アルコール製剤で皮膚消毒することを推奨している。このように推奨された背景として、良くデザインされた2つの研究においてクロルヘキシジン製剤の使用でポビドンヨードまたはアルコールよりカテーテルへの菌定着またはカテーテル関連血流感染の割合が低かったこと20、21)、0.5%クロルヘキシジンアルコールが10%ポビドンヨードと比較して中心静脈カテーテルへの菌定着またはカテーテル関連血流感染に差が見られなかったこと22)、2%クロルヘキシジン水溶液が10%ポビドンヨードまたは70%アルコールよりもカテーテル関連血流感染が減少する傾向にあること20)、4,143例のメタアナリシスにおいて、クロルヘキシジン製剤はポビドンヨードに対して49%までカテーテル関連血流感染のリスクを減少すること23)とする報告を参照している。米国医療疫学学会・米国感染症学会の勧告(2014年)24)でも生後2カ月以上の患者にはCDCガイドラインと同様に0.5%を超えるクロルヘキシジンアルコールの使用を推奨している。英国のガイドライン(2014年)25)では中心静脈カテーテルのみならず末梢静脈カテーテル挿入前の皮膚消毒およびドレッシング交換時の皮膚消毒に2%クロルヘキシジン70%イソプロパノールの使用を推奨している。透析時のカテーテル挿入部位の皮膚消毒についても米国感染管理疫学専門家協会の勧告(2010年)26)では0.5%を超えるクロルヘキシジン70%イソプロパノールを推奨しており、国内の国公立大学附属病院感染対策協議会のガイドライン(2015年)27)においてもアルコールを含んだ0.5%を越える濃度のクロルヘキシジンが推奨されている。
平素無害であるコアグラーゼ陰性ブドウ球菌(CNS)などの皮膚常在菌も、本来無菌である血管内に侵入すれば感染の起因となる。血管内カテーテルの挿入部位は、血管内が皮膚表面と長時間カテーテルによって通じている部分であるため、皮膚常在菌も可能な限り、かつ、持続的に減少させておくことが感染率の低下をもたらすと考えられる。クロルヘキシジンはポビドンヨードよりも持続効果が優れており28)、このような意味からも海外のガイドラインではクロルヘキシジン製剤の使用が推奨されている。日本においてはクロルヘキシジンエタノール液を内頸静脈穿刺部位に用いてアナフィラキシーショックが発現した例が報告されているので29)、クロルヘキシジンの適用時には濃度と副作用に注意が必要であるが、医療用医薬品再評価制度に基づき手指・皮膚に対して1%までの使用が認められている。国内の臨床使用例において1%クロルヘキシジンアルコール製剤は10%ポビドンヨード製剤に比べてカテーテル挿入部位の皮膚培養陽性率および感染率が低減できることが報告されている30、31)。
一方、英国のPHLS(Public Health Laboratory Service)の1997年暫定ガイドライン16、17)では挿入部位の消毒法として、「もし目視的にすでに清潔でなければ、石けんと水で、または滅菌生理食塩水かセトリミド(洗浄剤の一種)を含ませたガーゼによる清拭で洗浄するべきである。カテーテルを挿入する前に、少なくとも濃度70w/w%のアルコール(エタノール、工業用メタノール添加アルコール液、イソプロパノール)を基剤とするクロルヘキシジンまたはポビドンヨードで、綿球よりもガーゼを用いて、皮膚を前処置するべきである。その後、塗布部位が乾くまで、挿入処置を始めてはならない。生体消毒薬が作用する十分な時間を取るためである。」と述べている。皮膚の前処置に消毒薬のアルコール溶液を用いることは、持続的な効果とともに、アルコールの速効的な殺菌力や皮膚への浸透による常在菌の減少を期待できるという意味で妥当な選択であると思われる。なお、消毒薬を適用する前にアセトンを用いて皮膚を脱脂することはかえって皮膚を刺激し感染率を高める恐れがある32)。
③血管内留置カテーテル挿入部位の管理
カテーテル挿入期間中における挿入部位の管理には様々な方法がある。挿入部位を保護するドレッシング材には滅菌ガーゼや透明フィルムを用いる方法があるが、通常は透明フィルムを用いる方法が推奨されている18、19)。透明フィルムは挿入部位が継続的に容易に観察でき、ガーゼドレッシングと比べて交換頻度が少ない点でメリットがある。しかし発汗が多い場合や挿入部位に出血のある場合にはフィルムと皮膚の間に水分が貯留することになり、かえって細菌量を増やす場合もあるため、その場合にはガーゼドレッシングを適用する18、19)。また、透明フィルムにポビドンヨードを含有させたものが市販されているが、ガーゼを用いた場合、透明フィルムを用いた場合、ポビドンヨード含有の透明フィルムを用いた場合の菌陽性率を比較して差がなかったという報告があり33)、これらドレッシング材の選択によって感染率が変化するという確たる証拠はない。しかし近年、クロルヘキシジン含浸スポンジドレッシングが標準的なドレッシング方法に比べてカテーテル関連血流感染の発生率が低減したという報告があり34、35)、CDCガイドライン(2011年)18、19)では標準的な感染予防策を実施したにもかかわらず感染率が低減しない場合に、生後2ヵ月以上の患者においてはクロルヘキシジン含浸スポンジを使用することを推奨している。また、ドレッシング材は週に1回程度から、毎日交換する場合まであるが、頻繁に交換することが感染率を低下させると立証されているわけではない。CDCガイドライン(2011年)の勧告18、19)では使用するカテーテルの種類によってドレッシング材の交換頻度が異なっている。短期留置目的の中心静脈カテーテルの場合、ガーゼドレッシングは2日毎、透明ドレッシングは最低限7日毎に交換すること、トンネル型または埋め込み型の中心静脈カテーテルの場合は挿入部位が治癒するまで週に1回程度の割合で交換することとしている。ただし、これらの期間内であってもドレッシングが湿った場合や緩んだ場合、目に見えて汚れた場合には交換が必要である。なお長期カフ付きトンネルタイプの中心静脈カテーテルについて、治癒した出口部分のドレッシングの必要性については未解決問題となっている。カテーテルの交換については通常、末梢静脈カテーテルは72~96時間で交換するのが一般的であるが、中心静脈カテーテルでは、留置期間と感染率には特別な関連はないため、カテーテル交換はルーチンに行わないこととされている。
カテーテル挿入後のケアとして、カテーテル挿入部位にポビドンヨードゲルなどの消毒薬軟膏を適用する場合があり、ムピロシン軟膏などの抗菌薬軟膏を適用した報告例もみられるが、必ずしもこれらによって感染率が低下するとは限らない。ただし血液透析カテーテルの場合には、ポビドンヨードゲルによる感染率低下効果についてエビデンスがあり、前述のCDCガイドライン(2011年)18、19)では透析カテーテルの出口部分にはポビドンヨード軟膏または抗菌薬軟膏をカテーテル挿入後と透析終了時に適用することが推奨されている。なお中心静脈カテーテル挿入部位へポビドンヨードゲルなど消毒薬軟膏や抗菌薬軟膏を適用することについて、CDCガイドラインは勧告を明記していないが、感染率低下効果について結論的と合意されたエビデンスは存在せず、またポビドンヨードゲルには挿入部位の観察を困難とし、皮膚を軟化させ、ドレッシング材の密着に支障をきたすなどの問題点があるため、一概には推奨されない。
【ルート接合部の消毒】
●消毒用エタノール
●70%イソプロパノール
【血管カテーテル挿入部位の消毒】
●1%クロルヘキシジンエタノール液
●0.5%クロルヘキシジンエタノール液
●ヨードチンキ
●10%ポビドンヨード液
●70%イソプロパノール
●消毒用エタノール
(3)損傷皮膚36、37)
ここでは損傷皮膚として皮膚の創傷部位、粘膜の創傷部位、感染皮膚面、熱傷皮膚面、褥瘡の消毒について述べる。
①皮膚の創傷部位
皮膚の創傷部位には一般的な創傷と手術創がある。一般的な創傷は高度に汚染されている場合があり、生理食塩水などによる洗浄を行うことが第一選択となる。壊死部分がある場合には外科的に切除することを考慮する。消毒薬は細胞毒であり、創傷内に適用することはかえって治癒を遅らせる可能性があるため注意が必要である。特に深い創傷の場合には消毒薬を適用した後に生理食塩水などで洗い流すことが望ましい。ただし創傷周辺からの二次汚染を防ぐ目的で、創傷周辺の皮膚を広く消毒することは肝要である。この目的で使用される消毒薬としては、10%ポビドンヨード液、0.05%クロルヘキシジン液、ヨードチンキ、オキシドールがある。このうちオキシドールは毒性が低く、発泡により創傷内で洗浄作用を発揮するため、創傷内の処置に用いる場合がある。
一方、縫合された手術創の場合には創傷内の処置を行う必要がない。米国のガイドラインにおいては、術後24~48時間にわたって滅菌されたドレッシング材で被覆・保護することのみが勧告されている38、39)。日本においても滅菌されたドレッシング材で被覆する方法が勧告されているが40)、手術創やドレーン挿入部周辺からの二次汚染を防ぐ目的でガーゼによる被覆を行い、毎日周辺皮膚を消毒する方法も行われている。周辺皮膚に適用する消毒薬としては、10%ポビドンヨード液、0.05%クロルヘキシジン液がある。
②粘膜の創傷部位
粘膜の創傷部位の処置は皮膚の創傷部位の処置に準じる。ただし日本においてクロルヘキシジンの粘膜適用は禁忌であり、その代わりにベンザルコニウム塩化物、ベンゼトニウム塩化物を用いる。この目的で使用される消毒薬としては、10%ポビドンヨード液、0.02~0.025%ベンザルコニウム塩化物液、0.02~0.025%ベンゼトニウム塩化物液がある。
③感染皮膚面
感染皮膚面は難治化することや全身感染症に発展することもあるため、必要に応じて消毒薬を使用する。しかし、ある程度感染がコントロールされた場合には漫然と消毒薬の適用を続けるべきでない。なお、感染皮膚面への適用が明記されている消毒薬は、10%ポビドンヨード液、0.01%ベンザルコニウム塩化物液、0.01%ベンゼトニウム塩化物液がある。
④熱傷皮膚面
熱傷皮膚面は感染により難治化しやすい部位であるため、必要に応じて消毒薬を使用する。しかし、漫然と消毒薬の適用を続けるべきでない。熱傷は程度により、Ⅰ度:紅斑、Ⅱ度:水疱、びらん、潰瘍、Ⅲ度:壊死に分類される。Ⅱ度熱傷は浅達性のものと深達性のものに分けられるが、深達性Ⅱ度熱傷は感染を伴った場合にⅢ度熱傷へと進行するため、皮膚が再生しやすい条件を整える必要がある。熱傷の潰瘍面に細菌がいることは考えられるが、感染を起こしていない場合には毎日の入浴によってある程度まで細菌数を減らすことで十分である。局所的に感染しており消毒薬を用いた場合、残った消毒薬によって皮膚再生が遅れることが考えられるので、消毒後に生理食塩水などで洗浄する。なお、熱傷皮膚面への適用が明記されている消毒薬は、10%ポビドンヨード液のみであるが、広範囲の熱傷皮膚面へポビドンヨードを使用することでヨードが吸収され甲状腺機能亢進症、代謝性アシドーシス、腎不全などを生じた報告があるため41、42)、広範囲の熱傷皮膚面には使用しないようにする。
⑤褥瘡
褥瘡の消毒の必要性については明確なエビデンスがなく、専門家によって意見が一致していない。一般的には消毒薬が細胞毒性を有することが明らかとなっており、創傷部への消毒薬の使用は推奨されていないが、感染創に限っては使用を認めるべきとの意見もある。褥瘡の消毒にもっぱら使用されているポビドンヨード使用時のメタアナリシス解析によると使用当初は創傷治癒を遅延させるかもしれないが、全経過を通じては創傷治癒を妨げないとされている43)。
褥瘡は治癒過程による褥瘡の色の変化を反映して、黒色期、黄色期、赤色期、白色期に病期分類される。厚生省(現厚生労働省)監修のガイドライン(1998年)においては、黒色期から黄色期にかけては消毒薬を適用し、赤色期以降は生理食塩水による洗浄をすることが推奨されている44) (表Ⅲ-1)。また日本褥瘡学会のガイドライン(2012年)によると、褥瘡のケアは洗浄のみで十分であり、通常消毒は必要ないが、明らかな創部の感染を認め、浸出液や膿苔が多い時には洗浄前に消毒を行ってよいとしている45)。米国においては創面の洗浄や創傷の細菌を減らす目的で局所に細胞毒である消毒薬を用いるべきでないとされ、もっぱら生理食塩水を用いるよう推奨されている46)。また欧州においては水道水による洗浄を行うことと、細菌汚染の程度によって必要な場合にのみ消毒薬を使用することが推奨されている47)。
| 消毒薬の使い方 | a.ポビドンヨードなどの消毒薬は感染をコントロールする作用は強いが、細胞毒でもある。 b.消毒薬を含む外用剤は、感染がコントロールされた後には漫然と使用しない。 c.創面の消毒の功罪については様々な意見がある。消毒を行うとしても、壊死組織を伴い、感染の危険性の高い黒色期、黄色期のみに止めるべきである。 d.消毒後は生理食塩水で洗浄を行い消毒薬を残さない。ポビドンヨードであれば、消毒1~2分後に生理食塩水で洗浄する。 e.消毒薬、あるいは消毒薬を含む外用剤を使用する場合は、消毒薬に対するアレルギーに注意が必要である。ヨードアレルギーのものにポビドンヨードやポビドンヨードシュガーなどを用いてはならない。創周囲の健常皮膚に紅斑、小水疱が見られるときには、消毒薬による接触皮膚炎を考え、副腎皮質ホルモン剤を外用する。 |
|---|---|
| 創の洗浄 | a.毎日の処置において生理食塩水で創面を洗浄することによって、デブリドマンを促進する。 b.人肌程度に温めた生理食塩水で、ポケット内部も含めてよく洗浄する。肉芽組織を損傷しないために、ガーゼや綿球で創面を擦ったりしない。 c.生理食塩水のプラボトルの先に18G針や局所洗浄用ノズルを付けて洗浄を行うと便利である。 d.生理食塩水による洗浄後、創周囲の健常皮膚に残った水を乾いたガーゼ等で吸い取る。 |
【皮膚の創傷周辺の消毒】
●10%ポビドンヨード液
●0.05%クロルヘキシジン液
●ヨードチンキ
●オキシドール
【手術創の消毒】
●10%ポビドンヨード液
●0.05%クロルヘキシジン液
【粘膜の創傷周辺の消毒】
●10%ポビドンヨード液
●0.02~0.025%ベンザルコニウム塩化物液
●0.02~0.025%ベンゼトニウム塩化物液
【感染皮膚面の消毒】
●10%ポビドンヨード液
●0.01%ベンザルコニウム塩化物液
●0.01%ベンゼトニウム塩化物液
【熱傷皮膚面の消毒】
●10%ポビドンヨード液
(4)粘膜など36、37、48、49)
粘膜とは消化器、呼吸器、泌尿生殖器などの管腔臓器の内腔面をおおう部位の総称であり、その自由面は粘液腺や杯細胞からの分泌物で常に湿潤している。消毒の対象となる粘膜としては、口腔、咽喉、鼻腔、耳腔、結膜囊、腟、肛門などがある。またその周辺部位として外陰・外性器、歯科領域の根管がある。粘膜は結核菌やウイルス等の微生物に対して感受性があり、健常皮膚よりも感染しやすいが、健常な粘膜は一般的な芽胞による感染には抵抗性がある。粘膜に消毒薬を適用するのはもっぱら手術をする場合や感染を起こしている場合に限られるが、粘膜に適用できる消毒薬の種類は限られており、またその臨床的な効果についての知見は少ない。
クロルヘキシジンにおいては腟、膀胱、口腔、鼻腔など粘膜への適用によりショック症状の発現や鼓膜穿孔の報告がされており、日本においては粘膜適用が禁忌となっている。しかしながら日本病院薬剤師会が1998年に全国604施設で行ったアンケートの集計49)によると、耳鼻咽喉科で粘膜にクロルヘキシジンを使用している割合が16.6%にものぼっており、適正使用の普及が望まれる。
①粘膜
以下、粘膜に適用可能な消毒薬を列記する。
〈手術部位の粘膜〉
10%ポビドンヨード液が用いられる場合が多い。0.01~0.025%ベンザルコニウム塩化物液、0.01~0.025%ベンゼトニウム塩化物液も使用できる。
〈腟〉
0.02~0.05%ベンザルコニウム塩化物液、0.025%ベンゼトニウム塩化物液が使用できる。
〈結膜囊〉
界面活性剤の含まれない0.05%以下のクロルヘキシジン液、0.01~0.05%ベンザルコニウム塩化物液、0.02%ベンゼトニウム塩化物液が使用できる。消毒の効能はないが、結膜囊の洗浄に2%以下のホウ酸、1%以下のホウ砂を用いることができる。
〈口腔粘膜・耳鼻咽喉〉
含嗽にはポビドンヨードを有効成分とする含嗽剤が広く使用されている。歯肉・口腔粘膜にヨードチンキ、咽頭炎、喉頭炎、扁桃炎に複方ヨードグリセリンを使用することができる。口腔粘膜の消毒、および口内炎・外耳・中耳の炎症・鼻炎・咽喉頭炎・扁桃炎など粘膜の炎症にはオキシドールを用いることができる。扁桃炎・副鼻腔炎・中耳炎などの化膿局所の消毒にはアクリノール水和物液を用いることができる。また、0.2%ベンゼトニウム塩化物歯科用製剤が口腔内の消毒・抜歯創の感染予防用に市販されている。
このほかに粘膜適用のある消毒薬としてクレゾール石けん液、次亜塩素酸ナトリウム、アルキルジアミノエチルグリシン塩酸塩があるが実際に使用することはまれである。
②外陰・外性器
外陰・外性器の皮膚消毒には界面活性剤の含まれない0.02%クロルヘキシジン液のみが具体的な適用を認められているが、粘膜適用濃度の範囲でポビドンヨード、ベンザルコニウム塩化物、ベンゼトニウム塩化物なども使用可能である。アクリノール水和物には泌尿器・産婦人科手術における適用があり、ポビドンヨードを成分とする産科用製剤も市販されている。
尿道留置カテーテルに関連する尿路感染は発生頻度の高い医療関連感染である50)。感染原因としてはまず尿道カテーテル挿入時の医療従事者の手指や操作技法が考えられ、またカテーテル留置中における尿路粘膜の損傷によるものがある。感染予防のために尿路カテーテル挿入時には無菌操作で行う必要があり、挿入前の尿道口は適切な消毒薬または滅菌済みの溶液を適用することがCDCガイドライン(2009年)51、52)で推奨されている。消毒薬か滅菌水または生理食塩水の何れかを使用するべきかについては未解決問題であり、さらなる研究が必要である。また、日本においてはカテーテルが挿入されている尿道口周辺のケアとしてポビドンヨードなどで定期的に消毒する場合が多いが、ポビドンヨード1日1回および2回使用群、クロルヘキシジン1日1回および2回使用群、無処置の対照群の計5群において、尿路感染率がほぼ同等であることが報告されている53)。このようなことから、CDCガイドライン(2009年)51、52) (表Ⅲ-2)ではカテーテルが留置されている間は感染予防のために尿道口周辺を消毒する必要はなく、毎日の入浴あるいはシャワーでの尿道口表面の洗浄など日常的な衛生管理で十分であると勧告している。また英国の1997年暫定ガイドラインは16、54)、挿入時には社会通念的水準で清潔でなければ性器周辺をカテーテル挿入の前に石けんと水で洗うべきであること、尿道口のケアとしては結痂や汚染がないよう保つのに適切な間隔でシャワーまたは強くないビデで洗浄することのみを薦めている。英国の2014年ガイドラインも同様に、日常的に尿道口を清潔にしておくことが必要であることを勧告している25)。
| ・必要な場合のみ尿道カテーテルを挿入し、必要な期間に限り留置する。 ・カテーテルの無菌的挿入後には、その閉鎖式排尿回路を維持する。 ・カテーテルや採尿バッグの交換は定期的に行わない。 ・カテーテルや採尿バッグなどを取り扱う際には手袋やガウンを適宜使用し標準予防策を講じる。 ・尿流を確保する。 |
また米国のガイドライン(1981年)55)は膀胱洗浄について、洗浄に抗菌薬を使用しても感染発生までの日数が伸びるという一時的な効果が期待されるだけであり、かえって抗菌薬耐性菌を選択的に残存させ増殖させるという結果を伴うので、日常的に抗菌薬による膀胱洗浄を行うべきでないとしており、改訂版のガイドライン(2009年)51)でもこの考えは変わっていない。膀胱洗浄が必要となるのは、もっぱら術後に血栓などによって尿道閉鎖のおそれがある場合であり、洗浄剤としては生理食塩水などを用いることが適切である。
③歯科領域の根管
根管に適用できる消毒薬としては、ヨードチンキ、オキシドール、ホルマリン(クレゾールなどを加えて)、次亜塩素酸ナトリウム歯科用製剤がある。
【手術部位の粘膜の消毒】
●10%ポビドンヨード液
●0.01~0.025%ベンザルコニウム塩化物液
●0.01~0.025%ベンゼトニウム塩化物液
【腟洗浄】
●0.02~0.05%ベンザルコニウム塩化物液
●0.025%ベンゼトニウム塩化物液
【結膜嚢の洗浄・消毒】
●0.05%以下のクロルヘキシジン液(界面活性剤の含まれない)
●0.01~0.05%ベンザルコニウム塩化物液
●0.02%ベンゼトニウム塩化物液
【口腔粘膜・耳鼻咽喉等の消毒】
●ポビドンヨード液(含嗽)
●ヨードチンキ(歯肉、口腔)
●オキシドール(口腔粘膜、外耳・中耳の炎症等)
●アクリノール(扁桃炎等の化膿局所)
【外陰・外性器の消毒】
●0.02%クロルヘキシジン液(界面活性剤の含まれない)
●10%ポビドンヨード液
●0.02~0.05%ベンザルコニウム塩化物液
●0.025%ベンゼトニウム塩化物液
【歯科領域の根管】
●ヨードチンキ
●オキシドール
●ホルマリン
●次亜塩素酸ナトリウム
(5)手術部位の皮膚・粘膜36~40)
手術部位においては微生物に対するバリアとしての皮膚・粘膜が切開され、本来無菌である組織が開放されるため、感染の成立する危険性が非常に高い。したがって手術部位の消毒においては、周辺の皮膚・粘膜を含め手術部位の微生物数をできるかぎり少なくするように努めることが重要である。米国における定義に従うと手術創は表Ⅲ-3のように4クラスに分類され、また手術部位感染(surgical site infection、SSI)はその感染部位の深さにより、切開部表層感染、切開部深層感染、臓器・腔感染の3つに分類される。手術部位感染の危険性はこれらのクラスに応じて異なり、汚染度の高い手術においては消毒のみならず抗菌薬の予防的投与など内因性感染に対する対策が重要となる。
| クラス1 清潔 | 感染のない手術創であり、炎症のないもの。呼吸器、消化器、生殖器、感染していない尿路は含まれない |
|---|---|
| クラス2 準清潔 | 呼吸器、消化器、生殖器、尿路を含む管理された状態の手術創で異常な汚染のないもの |
| クラス3 汚染 | 偶発的な新鮮開放創。無菌技法に重大な過失があった手術、あるいは胃腸管からの著しい洩れ、および内部に非化膿性の急性炎症がある切開創 |
| クラス4 不潔・感染 | 壊死組織が残っている古い外傷、および臨床的に感染症状があるかまたは内臓が穿孔しているもの。術後感染の病原微生物は手術前から手術野に存在する |
①手術部位の皮膚
術前の手術部位の皮膚に適用のある消毒薬は多数あるが、米国における最近の研究では術前消毒において、2%クロルヘキシジンアルコール液は10%ポビドンヨード液に比べ手術部位感染率が有意に減少したとする報告がされている56)。メタアナリシスによる解析でもクロルヘキシジン製剤はポビドンヨード製剤に比べて手術部位感染が有意に低下すると評価されている57、58)。日本のガイドライン40、59)では10%ポビドンヨード製剤、クロルヘキシジン製剤、アルコール製剤(消毒用エタノール、イソプロパノール)の使用が推奨されているが、消毒用エタノールを用いる場合や、ポビドンヨード製剤を適用後ハイポアルコールで脱色する場合には、残留成分による持続効果を期待することができない。また、アルコールを含有した製剤を用いた後に電気メスを使用する場合には、引火の恐れがあるので必ず乾燥させてから電気メスを使用するべきである。
米国CDCの手術部位感染防止ガイドライン(1999年)38、39)における手術部位の前処置、術後ケアに関連する要点を表Ⅲ-4に示す。
表Ⅲ-4 米国CDCガイドライン(1999年)における手術部位に関連する要点
| A | 手術部位あるいは周辺の体毛が手術の支障となる場合を除いて術前の除毛は行わない。手術前の除毛はいかなる方法においても手術部位感染率の増加に結びつくからである。除毛する場合には、手術直前に、なるべく電気クリッパー(バリカン)を用いて除毛する。 |
|---|---|
| B | 少なくとも手術前夜に生体消毒薬を用いた術前のシャワー浴あるいは入浴をするよう患者に指示する。術前のシャワー浴が手術部位感染率を低下させるという証拠はないが、手術部位の微生物コロニー数は減少する。手術前に2回の生体消毒薬シャワーを浴びた700名以上の患者の研究によると、細菌コロニー数はクロルヘキシジンスクラブ、ポビドンヨードスクラブ、トリクロサン製剤によるシャワー浴においてそれぞれ、9分の1、1.3分の1、1.9分の1となった。 |
| C | 手術野および周辺部位を皮膚消毒する前に、大きな汚染を除去する目的で十分に洗浄する。 |
| D | 皮膚消毒のために適切な生体消毒薬を用いる。使用可能な消毒薬としては、ヨードホール(ポビドンヨード)、アルコール含有製剤、クロルヘキシジンなどがある。 |
| E | 術前皮膚消毒は、同心円を描くように中心から周辺に向かって行う。消毒範囲は場合により切開を延長しても、また新たな切開部位やドレーン挿入部位を追加しても良いように十分な広さとしなければならない。 |
| F | 一次閉鎖した切開創は、術後24~48時間の間は滅菌した被覆材(ドレッシング)で保護する。一次閉鎖した切開創を48時間以降も被覆するべきか否か、また手術創に被覆なしでシャワー浴または入浴する適切な時期については特に勧告しない。 |
②手術部位の粘膜
手術部位の粘膜の消毒には10%ポビドンヨード液が用いられる場合が多い。0.01~0.025%ベンザルコニウム塩化物液、0.01~0.025%ベンゼトニウム塩化物液も使用できる。このほかに適用のある消毒薬として次亜塩素酸ナトリウム、アルキルジアミノエチルグリシン塩酸塩があるが、実際に使用することはまれである。
【手術部位の皮膚の消毒】
●10%ポビドンヨード液
●10%ポビドンヨードエタノール液
●0.5%クロルヘキシジンエタノール液
【手術部位の粘膜の消毒】
●10%ポビドンヨード液
●0.01~0.025%ベンザルコニウム塩化物液
●0.01~0.025%ベンゼトニウム塩化物液
2)医療従事者
(1)手洗い概説60、61)
感染対策における最も基本的な要件として、医療従事者による手洗いの励行がある。医療従事者の手指は病原性微生物の伝播媒体となるため、正しい手洗いをマスターし、目的にあったレベルの手洗いが常にできるようにしておかなければならない。1997年英国の暫定ガイドラインは「ほとんどの場合において石けんによる手洗いこそが、交差感染を防ぎ、患者と従事者を感染から防御するために必要なすべてである」と述べている16、17)。
手指に存在する微生物は皮膚常在菌(定住フローラ、resident skin flora)と皮膚通過菌(一過性フローラ、transient skin flora)に分けることができる(表Ⅲ-5)。常在菌は、皮脂腺、皮膚のひだなどの深部に常在しており、表皮ブドウ球菌などのコアグラーゼ陰性ブドウ球菌(coagulase-negative staphylococci:CNS)が含まれ、消毒薬による手洗いによっても除去しきれない。通過菌は皮膚表面、爪などに周囲の環境より付着したもので、大腸菌等のグラム陰性菌や黄色ブドウ球菌等のグラム陽性菌など様々な微生物が含まれるが、抗菌成分を含まない石けんと流水でほとんど除去することができる。
| 皮膚常在菌 | 表皮ブドウ球菌などのCNS | 消毒薬でも除去しきれない |
|---|---|---|
| 皮膚通過菌 | 大腸菌等のグラム陰性菌 黄色ブドウ球菌等のグラム陽性菌など様々 |
石けんと流水でほとんど除去 |
病院における手洗いには日常的手洗い(social handwashing)、衛生的手洗い(hygienic handwashing)、手術時手洗い(surgical handwashing)の3種類がある(表Ⅲ-6)。
表Ⅲ-6 手洗いの種類
| 日常的手洗い | 配膳、トイレなど日常的行為の前後の手洗い |
|---|---|
| 衛生的手洗い | 注射、ガーゼ交換など医療行為の前後の手洗い |
| 手術時手洗い | 手術に際しての手洗い |
このうち日常的手洗いは、日常生活における手洗いと同様に、配膳の前やトイレの後などに行う簡易な手洗いである。流水のみの場合、石けんを用いる場合があるが、抗菌成分を含む石けんが用いられることもある。この手洗いによっても通過菌の一部を除去できるが、この手洗いの本質はあくまでも物理的な汚れの除去にすぎず、患者の処置前後などには、より念入りな衛生的手洗いを行う必要がある。
(2)衛生的手洗い(hygienic handwashing)60~67)
①衛生的手洗いの目的
主に医療において医療関連感染の予防策として行う手洗いであり、皮膚通過菌のほとんどを除去することを目的とする。必要な場面でこれを行うことにより手指を介した接触感染を防止することが最終的な目的である。
②衛生的手洗いの方法
正しい手洗い手順を守り十分な時間をかければ、抗菌成分を含まない石けんと流水による手洗いでほとんどの通過菌を除去することが可能であるが、抗菌成分入りの石けん、いわゆる薬用石けんを使用する場合もある。微生物により高度汚染されていると思われる場合などには、速効的な殺菌力のある消毒薬を用いて行う。乾燥にはペーパータオルなどを用い、タオルからの再汚染を受けないようにする。速乾性手指消毒薬によるラビング法は、簡便に確実な除菌を達成できる方法であり、日本において最も普及した手洗い法である。後述の2002年米国CDCガイドライン63、64)や2007年の改訂隔離予防策のガイドライン68、69)も日常的な手洗い法の基本として推奨しているが、目に見えるような汚れがある場合や芽胞形成菌などアルコールに抵抗性を示す微生物に接触した可能性がある場合には、まず石けんと流水による手洗いで汚れを除去しなければならない。緊急時などにおいては、アルコールを含ませた脱脂綿などで手指を清拭するスワブ法を行い、汚れを除去すると同時に消毒を行う場合もある。
基本的な知識として、通過菌は抗菌成分を含まない石けんによる手洗いでほとんど除去できることの理解が必要である66、67)。通過菌の除去の報告としてLowburyらは、事前に70w/w%エタノールで消毒した手指に、S. aureusを付着させ、石けんと流水による洗浄(30秒)、0.5%クロルヘキシジン液での洗浄、ポビドンヨードと流水による洗浄において、減菌率はそれぞれ99.62%、99.86%、99.97%であったと報告している70)。手洗いに関する多くの研究は、通過菌と同時に常在菌もカウントする実験手法を採用し、低い減菌率を報告している。
トリクロサン、トリクロカルバンなどの抗菌成分を含む石けん、いわゆる薬用石けんが、通過菌や常在菌の一部に殺菌力を発揮するのみならず、持続効果を発揮し、また連用による累積効果を持つ場合がある71~74)。これらの付帯的な効果が病棟における接触感染の防止においてどれほどの成果を上げるかは不明であるが、使い捨てのボトル容器の形で市販されている液体石けんは、固形石けんよりも清潔に使用することが容易であるため、薬用液体石けんを採用する医療機関が増えている。英国の1997年暫定ガイドラインでも使い捨て容器の形で市販されているものを採用するよう推奨している16、17)。
高度の微生物汚染があった場合の消毒薬としては、手術時手洗いに用いる4%クロルヘキシジンスクラブ、7.5%ポビドンヨードスクラブ、1%クロルヘキシジンエタノールローション、0.5%クロルヘキシジンエタノールローションと0.2%クロルヘキシジンエタノールローション、0.2%ベンザルコニウム塩化物エタノールローションなどの速乾性手指消毒薬がある。これらの消毒薬は、通過菌や常在菌の一部に速効的な殺菌力を発揮するのみならず、クロルヘキシジンなどの成分が皮膚常在菌に対して持続効果を発揮することも期待されているが、この持続効果が衛生的手洗いの目的、つまり病棟における接触感染の防止においてどれほどの成果を上げるかは不明である。
脱脂綿などによるスワブ法に用いるアルコール系消毒薬としては消毒用エタノール、70%イソプロパノール、イソプロパノール添加エタノール液などがある。
なお、衛生的手洗いの方法を考慮するときに重要な事項として手荒れの問題がある。手荒れを起こした手指は皮膚表面に無数の小膿瘍を形成し、手指上の細菌数が増加していることがある。また、冷水や消毒薬の適用時に刺激を感じるため、手洗いの励行に支障をきたす場合もある。消毒薬は手荒れを誘発する場合があり、頻繁に使用する消毒薬は、手荒れに配慮した製剤であるかを重視して選択するべきである。そもそも衛生的手洗いは抗菌成分を含まない石けんでも可能なものであり、殺菌力の強さのみを考慮して消毒薬を選択するべきではない。
③衛生的手洗いが必要な場面
衛生的手洗いのための適切な消毒薬や設備が採用、設置されても、必要な場面で手洗いが行われなければ感染対策がなされたことにはならない。頻繁に手洗いが行われているとしても、例えば処置後の手洗いが励行されているだけで、処置前の手洗いがあまり行われていない場合には、適切な感染対策がなされたことにはならない。米国CDCの2002年手指衛生ガイドライン63、64)では、手洗いは表Ⅲ-7に示す場面で行われるべきとしており、CDCの2007年隔離予防策ガイドライン68、69)では、表Ⅲ-8のように勧告している。またWHOのガイドライン(2009年)75)では手指衛生を実施する5つのタイミングとして、①患者へ接触する前、②清潔操作および無菌操作の前、③体液曝露の可能性があった後、④患者へ接触した後、⑤患者の周辺環境へ触れた後、を挙げている。
| 非抗菌性石けん (普通の固形石けんなど) |
手指が目に見えて汚れている場合 血液、体液などで汚染されている場合 |
抗菌性石けん(消毒薬配合スクラブ)と流水でも可 |
|---|---|---|
| 炭疽菌が疑われる場合など | ||
| 速乾性手指消毒薬を 日常的に用い手指消毒する |
患者に直接接触する前 | |
| 中心静脈カテーテル挿入時に滅菌手袋を着用する前 | ||
| 導尿カテーテル、末梢静脈カテーテルなど外科的処置を要しない侵襲的医療器具を挿入する前 | ||
| 患者の健常皮膚に接触した後 | ||
| 体液、排泄物、粘膜、非健常皮膚、創処置の後で目に見える汚染のない場合 | ||
| 同一患者の汚染部位から清潔部位に移る場合 | ||
| 患者の近傍物品に接触した後 | ||
| 手袋をはずした後 |
| 標準予防策 | 手指が目に見えて汚れている場合またはタンパク性物質に汚染されているとき、血液・体液によって見た目に汚れているとき | 非抗菌性石けんと流水または抗菌性石けんと流水による手洗い | |
|---|---|---|---|
| 芽胞(クロストリジウム・ディフィシルや炭疽菌など)に接触したおそれのある場合 | |||
| 手指が目に見えて汚れていない場合、または非抗菌性石けんと流水で目に見える汚れを取り除いた後 | 患者に直接接触する前 | 速乾性手指消毒薬による手指衛生が好まれる 代わりに抗菌性石けんと流水で手を洗っても良い |
|
| 血液、体液、排泄物、粘膜、健常でない皮膚、創部ドレッシング部位に触れた後 | |||
| 患者の健常皮膚に触れた後(脈や血圧の測定や患者の持ち上げなど) | |||
| 患者ケア中に汚染部位から清潔部位に手が動く場合 | |||
| 患者のすぐ近くにある無生物(環境医療器具を含む)に触れた後 | |||
| 手袋を外した後 | |||
感染経路別予防策下においても基本的な手洗い方法は変わりない。
英国の1997年暫定ガイドライン16、17)では、主に石けんと流水による手洗いが表Ⅲ-9のような場合に勧告されていたが、英国の2014年ガイドラインで表Ⅲ-10のような場合に手を清浄化しなければならない、と勧告した25)。
| ・感染しやすい部位、例えば創傷、熱傷、血管内留置カテーテル挿入部位に接触する前 ・侵襲的処置、例えば感染に対する自然防御能が破綻される処置を行う前 ・特に感染しやすい患者、例えば免疫不全患者や新生児に接触する前 ・食物や薬剤を扱う前 ・手指が汚染した後、例えば生体物質、汚染したリネンや器具に接触した場合 ・手袋をはずした後-使用中に穴が発生することは頻繁であり、または、はずすときに手指が汚染されることもあるので- ・隔離患者、または、例えば多剤耐性菌のように臨床上特別な重要性を持つ微生物が定着した患者に接触した後 ・トイレを使用した後、またはトイレの使用を介護した後 |
| ・清潔操作および無菌操作を含む直接の患者接触またはケアを行う直前 ・直接の患者接触またはケアの直後 ・体液、粘膜、健常でない皮膚に触れた直後 ・患者のすぐ近くで上記以外の動作を行った直後 ・患者のすぐ近くにある物品や器具に触れた直後 ・手袋を外した直後 |
④手洗いの手技
手洗いは、個々による自由な手順では手の甲や指先などを洗い損ねる場合が多いので、衛生的手洗いにおいては、常に全員が同じレベルでの除菌を行うことができるよう手洗い手順をマニュアル化することが望ましい。手洗い手順例を図Ⅲ-1、Ⅲ-2に示す。
図Ⅲ-1 衛生的手洗い手順例(速乾性手指消毒薬を用いる場合)
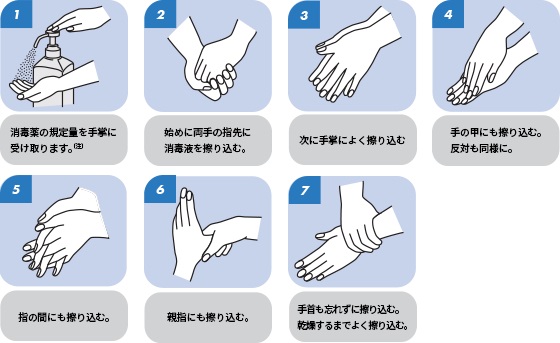
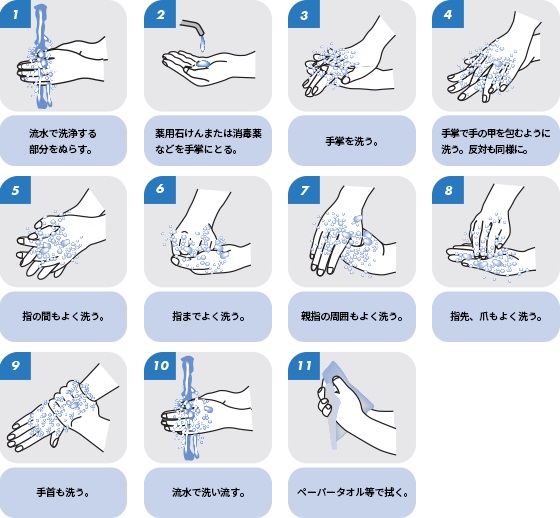
Ⅲ-2 衛生的手洗い手順例(流水を用いる場合)
⑤衛生的手洗いの実践
以上、衛生的手洗いの目的、方法、場面、手技について基本的な事項を解説した。衛生的手洗いは従来、多くのガイドラインにおいて、石けんと流水による30秒以上の手洗いであることが力説されていたが、多忙な医療現場においてこれを頻繁に実行することには困難を伴う。また手洗いのための流水設備が不足し繰り返し洗えない現状も存在する。近年、手洗いのコンプライアンス、すなわち手洗いの必要な場面でどれだけ有効な手洗いが実行されているかを観察し、どのような方法でその向上を図ることができるかを客観的に検討する研究が進んでおり、このような観点から衛生的手洗いについて以下のような実践的見直しが行われている70)。
流水による手洗いを有効とする研究の多くは30~60秒間かけた場合の評価に基づくものであるが、現実を観察すると医療従事者の手洗いの平均時間は7~10秒間程度であり、このような短時間手洗いの効果は疑わしく科学的根拠に乏しいといえる。一方、アルコールは手に付着している細菌を効果的に確実に減少させることができ、特別な設備も不要であり、ベッドサイドにて容易に使用することができる。さらに近年市販されている速乾性手指消毒薬には、手荒れ防止用のエモリエント剤が含まれており、手荒れの問題も改善されている。したがって実践的には、速乾性手指消毒薬の普及を図ることが最善の対策であるといえる。
このような観点から、簡便に使用でき確実に手の付着菌を減少させる速乾性手指消毒薬を用いて衛生的手洗いを実践することが感染対策のスタンダードとなっており、石けんと流水による手洗いは目に見える汚染がある場合やアルコールに抵抗性を示す微生物に汚染された可能性のある場合に限定されつつある。米国CDCの2002年手指衛生ガイドライン63、64)や2007年隔離予防策ガイドライン68、69)は、このような方針のもとに作成されたものである。
ただし、この点については補足が必要と思われる62、64)。目に見える手指の汚れがある場合に高度な微生物汚染を伴うことがあるので、前述のように必要に応じて消毒薬で手指消毒をすることが望ましい。消毒薬の速効性が期待できない微生物を対象とする場合には、流水による手洗いで物理的に除去することが基本であり、消毒薬には補完的な役割が期待されるにすぎない。以上のことから病棟での手指衛生における消毒薬の選択肢をまとめると表Ⅲ-11のようになる。
| 通常の手指衛生 | ・速乾性手指消毒薬の適用を基本とする (消毒薬配合スクラブ剤と流水による手洗いでも可) |
|---|---|
| 目に見える汚れのある場合 | ・石けんと流水による手洗いの後、必要に応じて速乾性手指消毒薬を適用 ・消毒薬配合スクラブ剤と流水による手洗い |
| 消毒薬抵抗性の強い微生物を 対象とする場合 |
エンベロープを有しないウイルス: ・石けんと流水による手洗いの後、速乾性手指消毒薬を適用 ・ポビドンヨード配合スクラブ剤と流水による手洗い 芽胞: ・石けんと流水による念入りな手洗い |
(3)手術時手洗い(surgical handwashing)38、39、60~65)
①手術時手洗いの目的
手術など侵襲的な手技の前に行われる手洗いであり、最も衛生水準の高い手洗いである。通過菌をほとんど除去し、かつ、常在菌も可能な限り減少させることを目的としている。平素無害な皮膚常在菌であっても、侵襲的操作などを介して通常無菌の体内組織などに入った場合には、感染を発生させることがあり、特に易感染患者においては、それが重篤な感染症を招く危険性が高い。したがって、手術などの侵襲的操作を行う場合には消毒薬を使って常在菌も可能な限り減少させ、かつ持続効果のある消毒薬を適用することが望ましい。
②手術時手洗いの方法
手術前の手洗いは常在菌の減少までを目的としているため、洗浄成分を配合する消毒薬(4%クロルヘキシジンスクラブまたは7.5%ポビドンヨードスクラブ)とブラシを用いて行うことが伝統的であるが、ブラッシングによる手指皮膚表面の損傷が手荒れなどを招きかえって微生物数を増やし得るという観点から、それらの消毒薬で十分揉み洗いしたあと速乾性手指消毒薬を用いるなどの改良法も採用されるようになった。
CDCの1999年手術部位感染防止ガイドラインの概説は手術時手洗いに用いる消毒薬に関して次のように述べている38、39)。
「理想的には、このスクラブに使用する最適な消毒薬は、広い抗微生物スペクトルを持ち、速効性で、持続効果があるべきである。……アルコールは欧州諸国で手術時手洗いの“定番(gold standard)”だと考えられている。アルコール含有剤は欧州よりも米国で使用頻度が低い。多分それは可燃性と皮膚刺激に対する配慮によるものである。ポビドンヨードとクロルヘキシジンが米国のほとんどの手術チームで現在選択されている。しかしながら、7.5%ポビドンヨードまたは4%クロルヘキシジンをクロルヘキシジンアルコール液(0.5%クロルヘキシジン70%イソプロパノール液)と比べると、クロルヘキシジンアルコール液の方が残留する殺菌活性が大きいことが知られている。すべての状況において理想的な消毒薬はない。殺菌効果以外の面において、繰り返し使った後に手術室のメンバーに受け入れられるものであるかどうかということも大切な要素である。」
ポビドンヨードとクロルヘキシジンとの比較では、一般にクロルヘキシジンの方が持続効果において優れていると判断されるが65)、どの消毒薬が抗菌力の面で優れているかという判断に基づく薬剤の選択は、おそらく決定的な事柄ではなく、むしろ手荒れなどの個体差に応じてこれら2剤の中から個々に選択できるように設置することや、仕上げとしてのクロルへキシジン配合アルコール製剤などの速乾性手指消毒薬と組み合わせて用いるようにすることなどの配慮や工夫が重要である。
また、手洗いの時間とブラシの使用について前述の手術部位感染防止ガイドライン(1999年)の概説は、次のように述べている。
「最近の研究では少なくとも2分間の手洗いで従前の10分間の手洗いと同程度、手の細菌コロニー数を減らす効果があることが示唆されたが、最適なスクラブ時間は判明していない。1日の最初のスクラブは(通常ブラシを用いた)爪の下までの徹底的な洗浄を伴わなければならない。このような洗浄がその後のスクラブにおいても必要であるかどうかは明白でない。」
なお、米国外科学会(ACS)では1985年には最低5分間の手洗いを推奨していたが、1995年には指先部分のみのブラッシングを併用した最低120秒間の手洗いを推奨した65)。
このように近年は、微生物学的な観点から皮膚の損傷を最小限とすることの必要性が重視され、手洗いの時間やブラシの使用は削減される方向にある。しかし、何分間手洗いをする必要があるか、どの程度ブラシを用いる必要があるかなどは、その日の最初の手術時手洗いであるか、どの消毒薬を用いるかなどによっても左右されうる。
さらに、速乾性手指消毒薬を用いた手術時手洗いと従来からの消毒薬配合スクラブを用いた手術時手洗いを比較して、手術部位感染の発生率に差のないことが報告されている78)。
このようなことから速乾性手指消毒薬による擦り込む方法が普及しつつあり、その有用性について多くの報告がある。この方法は消毒薬配合スクラブ剤を用いた方法よりも持続活性に優れ、手荒れを起こしにくく、手洗いに要する時間の短縮、コスト削減などのメリットがある63、64、79~82)。また、国内のガイドライン(2013年)59)では、持続殺菌効果のある速乾性手指消毒薬もしくは抗菌性石けん(生体消毒のスクラブ剤)を用いる、としているが、従来のブラシを用いるスクラブ法に対して、ブラシを使わずに速乾性手指消毒薬を手指から前腕に十分に擦り込む方法が推奨されている。なお、米国CDCの2002年手指衛生ガイドラインは63、64)、手術時手洗いについて表Ⅲ-12のように勧告している。
| 指輪、時計、腕輪などをはずし、流水と爪クリーナーで爪の下の汚れをとる。 |
| 滅菌手袋を着用する前に、持続効果のある抗菌性石けんまたは速乾性手指消毒薬で手指消毒を行う。 |
| 抗菌性石けんを用いる場合には、通常2~6分間、手と前腕をスクラブする。長時間スクラブする必要はない。 |
| 速乾性手指消毒薬を用いる場合には、事前に非抗菌性石けんにより手と前腕を洗い完全に乾燥させる。 |
具体的な方法としては以下のような手洗いが考案されている60)。
・ディスポーザブルブラシを使用した6分間1ブラシ法(表Ⅲ-13)
・ディスポーザブルブラシを使用した3分間1ブラシ法(表Ⅲ-14)
・指先のみにブラシを使用した3分間法
・ブラシを使用しない3分間揉み洗い法
・持続殺菌効果のある速乾性手指消毒薬による擦りこみ法(表Ⅲ-15、Ⅲ-16)
表Ⅲ-13の6分間1ブラシ法では、比較的柔らかい使い捨てブラシ(1個)が採用されているが、細菌数において再使用ブラシ(2個)による7分間手洗いとの有意差はなかった61)。また、表Ⅲ-14の3分間ブラッシング法で、ブラッシングに各手順に倍の時間をかけた6分間法と比較して、手洗い後の細菌数に有意差はなかったという報告もある84)。表Ⅲ-15および表Ⅲ-16に速乾性手指消毒薬法の実例を示す。
| 1 | 服装を整え、爪が短く切ってあるかを確認する。 |
|---|---|
| 2 | 消毒薬をよく泡立てながら上腕1/2まで素洗いする。腕は水平にして手洗いをする。 |
| 3 | 滅菌済みブラシに消毒薬をとり、ブラッシングを行う。手指、前腕の末梢1/2、前腕から上腕1/3と3部分に分けて、末梢から行う。上腕1/3までのブラッシングを両側で4分間かける。前腕から上腕1/3までの両腕4部分を2分間かけて洗う。 |
| 4 | 流しなど周囲に触れないように、指先を高くして流水で洗い流す。 |
| 5 | 指先から滅菌した不織布で手を拭く(指先を下げない。最も高い清潔度を要求されるのは、指先である)。 |
| 6 | 速乾性手指消毒薬による擦り込みを行う。これは、常在菌の死滅または増殖の静止のためである。 |
| 1 | 素洗い2分間:衛生的手洗いであり、適量の4%クロルヘキシジンスクラブあるいは7.5%ポビドンヨードスクラブにより、指先から上腕1/2まで30秒間洗い、流水で洗い流した後再び同様に1分30秒間の揉み洗いを行う。 |
|---|---|
| 2 | ブラッシング3分間:滅菌したディスポーザブルブラシを素手で取り出し、同一の消毒薬を約5mL滴下し、指先から上腕1/3までをブラッシングする。まず左手の爪部を15秒間、続いて指の間を15秒間、手背を15秒間、手掌を15秒間洗い、同様に右手を洗い、左右あわせて合計2分間行う。さらに左右前腕1/2を15秒間、残りの1/2を15秒間の合計1分間ブラッシングする。その後流水にて肘を低く保ちながら洗い流す。 |
| 3 | 手拭き:ディスポーザブル滅菌不織布製手拭きタオルを2枚取り出し、手関節より末梢部分をまとめ拭きした後、左右1枚ずつ使用して肘関節に向けてしごき拭きあげる。 |
| 1 | 非抗菌性石けんによる手洗い:非抗菌性石けんによる手洗いを30秒間行い、さらにもう一度90秒間行う。その際、爪ピックは用いるがブラシは用いない。手洗い後、非滅菌ペーパータオルで拭く。 |
|---|---|
| 2 | 速乾性手指消毒薬の適用:0.2%クロルヘキシジン配合の速乾性手指消毒薬を1~1.5分間かけて擦り込み、さらにもう一度1~1.5分間かけて擦り込む。指先には特に丁寧に揉みこむ。 |
| 1 | 抗菌性石けんで手、前腕を揉み洗いした後、非滅菌ペーパータオルで拭き取る。(指先にはブラシを使用してもよい)60~90秒間 |
|---|---|
| 2 | 0.2%クロルヘキシジンエタノール擦式製剤を1回3~5mL使用し、1)前腕への擦り込みを左右2回ずつ、2)指先に消毒薬を十分塗布した後に両手指への擦り込みを左右2回ずつ行う。180秒間程度 |
この他にも具体的な方法が提案されているが、どれが最善であると判断することはむずかしい。どの方法を採用するかということよりも、どの方法であれマニュアルに沿った手術時手洗いがそれを必要とする全員によって的確になされることのほうが重要であろう。
2 器具および環境48、60、85~94)
器具および環境の滅菌・消毒においては、基本的にそれぞれの対象物に求められる清浄度に応じて滅菌・消毒方法を選択しなければならない88、89)。血液や体液の付着した器具に関して患者の感染症ごとに消毒方法を変更することは、スタンダードプリコーションの原則に反することとなる。また、滅菌・消毒の手順を明確に定め、常に必要な清浄度の水準が達成されるよう滅菌・消毒業務を確立することも重要である。個々の医療従事者により消毒の手順が異なる場合には、感染対策の質が保証されているとは思われない。一方、必要とされる以上のレベルで滅菌・消毒を行っても、それは労力や経費の無駄であり、かえって有害な対策となる場合もある。例えば病室の環境清掃において高水準消毒薬を使用することは無駄であり有害であるので、行うべきでない90、91)。
1)器具48、60、87、92~94)
器具の消毒水準と消毒方法は、どのような感染症例に使用した器具であるかではなく、どのような用途に再使用する器具であるかを基準として決定するのが基本である。つまり、器具の使用用途に応じて必要な消毒水準を定めるべきであり、このような標準予防策的な対策が徹底している場合には、患者の感染症によって消毒方法を変更するべき場合は限られている。もっぱら感染症の種類により消毒マニュアルを定めている医療機関においては、標準予防策の原則に照らしてマニュアルに問題がないか再検討を加える必要がある。器具を使用用途ごとに分類した体系としては、Spauldingの提唱した体系が明解かつ合理的であるため、現在も多くのガイドラインがそれに準拠している。Spauldingの分類によると、患者ケアに用いられる器具や物品は、それらが関与する感染リスクの程度によって表Ⅲ-17の3つに分類される48、87、92)。
| 器具分類 | 用途 | 例 |
|---|---|---|
| クリティカル器具 (critical items) |
無菌の組織や血管に挿入するもの | 手術用器具、循環器または尿路カテーテル、移植埋め込み器具、針など |
| セミクリティカル器具 (semi-critical items) |
粘膜または健常でない皮膚に接触するもの | 呼吸器系療法の器具や麻酔器具、軟性内視鏡、喉頭鏡、気管内挿管チューブ、体温計など |
| ノンクリティカル器具 (non-critical items) |
健常な皮膚とは接触するが、粘膜とは接触しないもの | ベッドパン、血圧計のマンシェット(カフ)、松葉杖、聴診器など(ベッド柵、テーブルなど環境表面を含めてノンクリティカル表面と言う) |
| 滅菌 (sterilization) |
いかなる形態の微生物の生命をも完全に排除または死滅させる。* |
| 高水準消毒 (high-level disinfection) |
芽胞が多数存在する場合を除き、すべての微生物を死滅させる。 |
| 中水準消毒 (intermediate-level disinfection) |
結核菌、栄養型細菌、ほとんどのウイルス、ほとんどの真菌を殺滅するが、必ずしも芽胞を殺滅しない。 |
| 低水準消毒 (low-level disinfection) |
ほとんどの栄養型細菌、ある種のウイルス、ある種の真菌を殺滅する。 |
*現実には完全な排除または死滅を保証することはできず、無菌性保証水準を設定して運用する。詳しくはⅡ.1.滅菌・消毒とはを参照。なお、ここでプリオンは対象外であり、通常の滅菌条件では不活性化されない。
| クリティカル器具 | 滅菌が必要。 |
| セミクリティカル器具 | 高水準消毒が必要。ただし、一部のセミクリティカル器具(健常でない皮膚に接触する水治療タンク、粘膜に接触する体温計)は中水準消毒でよい。また、歯科用セミクリティカル器具は耐熱性であれば加熱滅菌する。(注) |
| ノンクリティカル器具 | 低水準~中水準消毒または洗浄、清拭を行う。 |
また、ノンクリティカル器具の消毒が必要となるのは、主に接触予防策が必要な場合であり、その他の場合には血液や体液が付着した場合などを除き特に必要性がない85、86)。接触予防策の主な対象であるMRSAやVREは低水準消毒を適切に行えば殺滅することができるので、接触感染するウイルスを対象とする場合などを除き、感染症の種類によって消毒水準を区別する必要性はない。ただし湿潤した器具・環境には低水準消毒薬に強い抵抗性を示すグラム陰性菌が存在するので、それらにはアルコールや次亜塩素酸ナトリウムなどを用いる。
(1)クリティカル器具48、60、87、93、94)
クリティカル器具とは、芽胞を含め、いかなる微生物で汚染された場合にも高い感染の危険性が生じるものであり、組織や血管、または血液が通過するものが含まれる。具体的には手術器具、循環器または尿路カテーテル、移植埋め込み器具、針などがある。クリティカル器具には無菌性が求められるため、可能であれば予め滅菌された単回使用を目的とした製品を使用し、これらの製品が使用できない場合には高圧蒸気法などにより滅菌を行った上で再利用する。なお、単回使用を目的とした製品の再利用は原則として認められていない98)。一方、関節鏡、腹腔鏡などは、滅菌ではなく2~3.5%グルタラ-ル製剤などによる高水準消毒を行うこともある。高水準消毒であることによって関節鏡などによる感染リスクが高まるという証拠は特にない48)。
これらの器具を滅菌するときには、まず念入りな前洗浄を行う必要がある。日本では病棟などで一次処理し感染性を低めてから中央材料室へ搬入する方式が伝統的であるが、この方式では一次処理作業において医療従事者が血中ウイルスに曝露する危険性がある。そのため、最近は病棟での一次処理は行わず、そのまま専用コンテナなどに入れて中央材料室へ運び込む方式が基本とされ普及しつつある。しかし病棟で一次処理をせず時間が経過した場合、器具に付着している血液・体液などが乾燥・固着することが多いため、中央材料室では、超音波洗浄を組み込んだウォッシャーディスインフェクターを使用するのがよい。これは熱水噴射により固着した汚れを含めて洗浄が可能であり、また熱水の微生物殺滅力により問題となるような病原性微生物の感染性を消失させることができるので、その後の滅菌作業における感染の危険性をほとんどなくすことができる。このような専用の洗浄装置が利用できない場合には、手作業によりブラシと中性洗剤または酵素洗浄剤などを用いて血液などの汚れを機械的に除去しなければならない。
前洗浄の後、耐熱性の器具であれば高圧蒸気滅菌を行う。非耐熱性の器具の場合には酸化エチレンガス滅菌や過酸化水素低温ガスプラズマ滅菌を行う。また滅菌に準ずる方法として2~3.5%グルタラール製剤による処理を行う場合には芽胞による汚染を考慮に入れ6時間以上浸漬し60、99)、滅菌精製水を用いて消毒薬を洗い流す。
なお米国のFDA基準では、クリティカル器具などに使用して滅菌を行える消毒薬を化学滅菌剤(chemical sterilants)と呼び、2%以上のグルタラール製剤への20~25℃ 10時間浸漬、0.2%過酢酸への50~56℃ 12分浸漬、7.5%安定化過酸化水素への20℃ 6時間浸漬などを挙げることができる100)。しかしながら、化学滅菌剤は適切な前洗浄が行われたとき、かつ接触時間、温度、pHが適切であるときのみ信頼できるものであり、使用法に注意が必要である48)。また必ずしもSAL=10-6といった無菌性保証水準を達成するものではない。なお、医療用器具消毒薬としての安定化過酸化水素はまだ日本で市販されていない。
(2)セミクリティカル器具48、60、87、93、94)
セミクリティカル器具とは、粘膜または健常でない皮膚に接触するものであり、これらの器具には少数の芽胞を除きいかなる微生物も存在してはならない。健常な粘膜は一般的な芽胞による感染に対して抵抗性があるが、抗酸菌やウイルスなどその他の微生物には感受性がある。セミクリティカル器具として具体的には呼吸器療法器具、麻酔器具、軟性内視鏡、喉頭鏡、気管内挿管チューブ、食道検圧プローブ、直腸肛門検圧カテーテル、避妊用リングなどが挙げられる。セミクリティカル器具の再利用には通常、熱水洗浄または消毒薬による高水準消毒が必要であるが、粘膜に触れる体温計(口腔用、直腸用)や健常でない皮膚をもつ患者の水治療タンクについては、中水準消毒でよいとされている。
代表的な高水準消毒薬としてはグルタラール、フタラール、過酢酸が挙げられるが、欧米では安定化過酸化水素も使用されている。高濃度(1,000ppm以上)の次亜塩素酸ナトリウムへの30分間浸漬も高水準消毒に分類されるが48)、この消毒薬は金属腐食性が強く、セミクリティカル器具の消毒に用いられる場合は限られている。いかなる消毒薬を用いる場合でも、血液や体液が付着した器具を消毒する場合には十分な効果を得られない可能性があるので、中性洗剤や酵素洗浄剤を用いて十分に前洗浄を行うことが肝要である。
ところで、これらの化学的消毒法は作用時間、濃度、温度、pH、有機物の除去など効力に影響を与える因子が十分に整った場合にのみ必要な消毒水準が確保されるものであり、消毒作業者に対する接触・吸入毒性や患者に対する残留薬剤の危険性などについて十分に留意すべき消毒法である。これらのことを考慮すると、セミクリティカル器具であっても熱に耐えるものである場合には、ウォッシャーディスインフェクターなどによる熱水洗浄を第一選択とすることが確実で安全である。100℃以下の熱水そのものは芽胞に対して無効であるが、洗浄作用を伴う場合には高水準消毒の代替法として十分な効果を発揮する。
消毒薬によって消毒されたセミクリティカル器具は、滅菌精製水ですすぐことが望ましい。すすぎに水道水を用いる場合には、水道水に含まれている危険性のある非結核性抗酸菌やレジオネラによる再汚染に注意が必要である。したがって水道水ですすいだ後はアルコールでリンスし、かつ強制乾燥することが望ましい。この強制乾燥には細菌の増殖しやすい湿潤環境を取り除き保管中の器具における細菌増殖を防ぐという意味もある。
①軟性内視鏡101、102)
軟性内視鏡は損傷した消化管や気管粘膜にも接触するため、できれば滅菌処理することが望ましい。しかしながら、耐熱性がなく高圧蒸気滅菌などでの処理が不可能であるため、高水準消毒薬であるグルタラール、フタラール、過酢酸による再処理を行う。この再処理は患者間でその都度行うことが原則であるが、その浸漬時間については議論がある。
2~3.5%グルタラールへの浸漬時間は、日本において承認されているグルタラール製剤の用法によると30分間以上(3%製剤では15分間以上)となっているが、日本消化器内視鏡学会のガイドライン(1998年)103)および日本消化器内視鏡技師会消毒委員会のガイドライン(2004年)では10分間と規定された104)。この10分間という浸漬時間は世界消化器病学会のMinimal standards for disinfections of endoscopic instrumentationにおいても推奨されている105)。
米国においてもこのような薬事承認と学会見解の相違がみられ、FDAの承認した2.4%グルタラールの軟性内視鏡全般のための用法は25℃ 45分間となっているが、APICのガイドラインにおいては2%グルタラールで20℃ 20分間以上と推奨されている48、102)。APICは、FDAの審査基準においては高度の結核菌汚染があった場合の試験データに基づいて用法が設定されるため、現実に必要な時間よりも長い時間が設定されたとの見解をとっており、その論拠として用手による機械的な内視鏡洗浄が汚染微生物を約4log(すなわち99.99%)減少させることを確認した研究をあげ、前洗浄が確実にできていれば消毒時において高度な微生物汚染は存在しないという立場をとっている。
英国においては、内視鏡に2%グルタラールを用いる場合、通常は10分間以上、結核による感染がわかっているか疑わしい場合については20分間以上、芽胞については少なくとも3時間の浸漬が必要であると規定されている106)。
以上のことから、消化器内視鏡による結核伝播の可能性が低いことも合わせて考慮すると、2%グルタラールを軟性内視鏡に用いる場合の浸漬時間は消化器内視鏡で10分間以上を基本とするのが妥当と思われ、この条件は2013年に公表された日本環境感染学会、日本消化器内視鏡学会、日本消化器内視鏡技師会のマルチソサエティ実践ガイドでも推奨されている107)。ただし、気管支内視鏡においては結核菌伝播のリスクがあるため108)、浸漬時間には注意が必要である。
なお、フタラールの浸漬時間については、日本において承認されているフタラール製剤の用法によると5分間以上となっているが、FDAは0.55%フタラールについて20℃ 12分間で高水準消毒と承認しており100)、日本のマルチソサエティ実践ガイドでは10分間としており107)、この条件は高度の結核菌汚染にも有効である。
グルタラールに対して比較的抵抗性を持つ結核菌やMycobacterium chelonaeなどの非結核性抗酸菌が多数存在する場合にはかなり長い接触時間が必要であること、また、チャンネル内にバイオフィルムなどが形成された場合には時間が経過しても消毒薬が十分浸透せず消毒が不完全になってしまうことを勘案すると、内視鏡を消毒するにあたっては前洗浄でのブラッシングは非常に重要な操作である。また内視鏡再処理の最後に乾燥を目的としてアルコールリンスを行うが、グルタラールに低感受性を示す抗酸菌であってもアルコールに対しては感受性を示すと報告されているため104、109、110)、アルコールリンスを行うことは、この意味でも重要な操作である。
軟性内視鏡の主な洗浄・消毒手順は表Ⅲ-20のとおりである。生体組織内に直接侵入する生検鉗子などの部品はなるべくディスポーザブル製品を用い、それができない場合には滅菌処理をした上で再利用する。なお、内視鏡は洗浄・消毒の均一化、および人体への消毒薬曝露防止、作業量の軽減などを考慮して、内視鏡自動洗浄装置を用いることが望ましい107)。
【軟性内視鏡の消毒】
●2~3.5%グルタラール
●0.55%フタラール
●0.3%過酢酸
| 1.ベッドサイドでの洗浄・消毒 | (1)検査終了直後に、内視鏡外表面の清拭と吸引・鉗子チャンネルの吸引洗浄を行う。 (2)送気・送水チャンネルへの送水は、専用(air/water:A/W)チャンネル洗浄アダプターを装着して、送水チャンネルと送気チャンネルの両方に送水する。 (3)内視鏡に接続したケーブルおよび吸引チューブは、消毒用エタノール清拭により消毒すると共に、汚染が拡大しないように抜去する。 |
|---|---|
| 2.洗浄室での用手による洗浄 | (1)漏水テストの実施: 検査終了後、症例ごとに漏水テストを行う。 (2)内視鏡外表面の洗浄: 鉗子起上装置を含め、内視鏡外表面の汚れを十分に落とす。 (3)送気・送水ボタン、吸引ボタン、鉗子栓などの洗浄は、それぞれの内視鏡から外して行う。 (4)吸引・鉗子チャンネルの洗浄: チャンネル洗浄ブラシを用いて、全てのチャンネルをブラッシングする。 (5)洗浄液のすすぎ: 洗浄後、内視鏡外表面、チャンネル内のすすぎを十分に行う。 |
| 3.消毒 | (1)内視鏡の消毒に用いる消毒薬: 高水準消毒薬である過酢酸、グルタラールおよびフタラールを用いる。 (2)過酢酸、グルタラールおよびフタラールは付着や蒸気曝露に注意して取り扱う。 (3)消毒薬の使用期限は、経時的な分解や水による希釈率などを考慮して決定する。 (4)消毒後の内視鏡はすすぎを十分に行う。 (5)すすぎ後は内視鏡の吸引・鉗子チャンネルにアルコールフラッシュを行い、送気や吸引を行ってすべての管路を乾燥させる。 |
| 4.洗浄・消毒の履歴管理 | 洗浄・消毒の記録を残す。(実施年月日、時刻、患者氏名、内視鏡番号、担当者氏名、内視鏡自動洗浄・消毒装置番号、消毒薬濃度、内視鏡自動・洗浄装置の運転状況など) |
| 5.保管 | 内視鏡は、送気・送水ボタン、吸引ボタン、鉗子栓などを外して保管庫に保管する。 |
②呼吸器系装置
人工呼吸器、ネブライザー、吸入麻酔装置などの呼吸器系装置は、その回路を通過する空気や加湿水などの飛沫が呼吸器粘膜に触れるためセミクリティカル器具に分類され、患者間においては高水準消毒ないし滅菌を行うことが原則である111)。しかしながらその構造は複雑で高水準消毒や滅菌を行うことが困難な場合が多い。したがって呼吸器系装置においてはパスツーリゼーション(70℃を超える熱水による30分間処理)や熱水消毒(80℃ 10分間)が高水準消毒の代替として認められている111、112)。熱水や消毒薬を循環させることができない装置である場合には、蛇管ホースや加湿水タンクなどの部分を取り外して消毒を行うことになる。
湿熱に耐えない部分であってもグルタラールなどを使用すれば高水準消毒を達成できるが、残留薬の毒性を考慮するとかえって危険である場合が多い。また、これらの器具において実際に感染伝播の危険を生むのは緑膿菌などのグラム陰性菌である場合が多いので、揮発性があり残留の少ない低濃度の次亜塩素酸ナトリウム(100ppm、1時間)を用いて中水準消毒を行うことが多い97)。
滅菌法、熱水消毒、パスツーリゼーション、高水準消毒薬やアルコール系消毒薬との十分な接触は結核菌など抗酸菌に有効であるが、次亜塩素酸ナトリウムは高濃度でなければ無効である。呼吸器系装置の消毒に低濃度の次亜塩素酸ナトリウムを用いている場合などには、結核の可能性によって消毒薬の濃度、接触時間、種類などを変更する 。
なおこれらの呼吸器系装置の加湿水中でグラム陰性菌が増殖することが多いので、加湿水には滅菌精製水を用い少なくとも24時間以内に交換する。
【呼吸器系装置の消毒】
●100ppm(0.01%)次亜塩素酸ナトリウム液
③気管カテーテル・経鼻カテーテル
これら気道粘膜に接触するカテーテルにはディスポーザブル製品を用いる。ただし喀痰の吸引カテーテルなど頻繁に使用するものは、同一の患者に使用するかぎりにおいて、高水準消毒をすることなく再使用する場合がある。この場合カテーテルの微生物汚染を最小限に止めることを目的として消毒用エタノールで清拭したり滅菌済みの0.1%ベンザルコニウム塩化物液や0.05~0.2%アルキルジアミノエチルグリシン塩酸塩液に浸漬することがあるが、少なくとも24時間以内にカテーテルと浸漬用薬液を交換する。なお0.1%ベンザルコニウム塩化物液に8~12%のエタノールを添加して細菌汚染の可能性を低下させる場合もある。カテーテルの吸引洗浄用水は汚染が甚だしいため、頻回に新しいものと交換する。なお、消毒薬に浸漬した吸引カテーテルは毎回滅菌精製水で洗浄するか、もしくはアルコール綿で外側を消毒してから再使用する。この場合、アルコール残留による気道刺激に注意が必要である。
【吸引カテーテルの消毒(同一患者に使用)】
●消毒用エタノール
●0.1%ベンザルコニウム塩化物液
●0.05~0.2%アルキルジアミノエチルグリシン塩酸塩液
● 8 ~12%エタノール添加0.1%ベンザルコニウム塩化物液
④体温計
体温計はアルコール系消毒薬で清拭して中水準消毒する。ただし、口腔用と直腸用は区別し兼用しない。また、隔離の必要なMRSA患者などに使用する体温計は他の患者と共用しない。
【体温計の消毒】
●消毒用エタノール
●70%イソプロパノール
(3)ノンクリティカル器具48、60、85、86、93、94、113、114)
ノンクリティカル器具とは、健常な皮膚と接触するが粘膜や健常でない皮膚に接触しない器具であり、感染伝播には通常関与しない。したがって高度な汚染を受けないかぎり日常的な洗浄・清拭のみで十分であり、特に消毒の対象とはならない。ただし、接触予防策下においてはノンクリティカル器具について使い捨てもしくは患者専用にすることが望ましいが、複数の患者で共用する場合には他の患者の使用前に低水準消毒もしくは中水準消毒を行う。またMRSA、VREなどの多剤耐性菌による感染または保菌が判明している場合にはノンクリティカル器具であっても患者専用にすることがCDCの2006年多剤耐性菌対策ガイドラインで勧告されている115、116)。なお、ノンクリティカル器具が血液などで汚染された場合には、よく洗浄した後、1,000ppm(0.1%)次亜塩素酸ナトリウム、場合によりアルコールで消毒する。
ノンクリティカル器具として具体的には、聴診器、血圧計のマンシェット(カフ)、松葉杖、ベッドパン、水枕などがあげられる。本テキストでは、リネン、食器、浴槽、洗面台などを物品に分類し、またベッド枠、ベッドテーブル、ドアノブ、医療機器表面などをベッド周辺として環境に分類し、消毒法について後述する。 ノンクリティカル器具の洗浄・清拭は定期的に行うべきである。また上述のように血液などで汚染された場合に汚染の除去と消毒が必要なこと、および接触予防策においてノンクリティカル器具を共用する場合に患者毎に消毒が必要なことは広く合意されている85、86、112)。しかし、その他の場合について、どのような場合にどのような頻度で消毒が必要であるのかについては様々な議論がある114)。
ノンクリティカル表面を消毒する場合には、通常下記のような消毒薬で清拭または30分間浸漬して消毒する。ただし、耐熱性・耐水性の器具の場合には、熱水消毒を選択することが望ましい。
・熱水(80℃ 10分間)
・0.1~0.2%ベンザルコニウム塩化物液
・0.1~0.2%ベンゼトニウム塩化物液
・0.1~0.2%アルキルジアミノエチルグリシン塩酸塩液
・アルコール系消毒薬(消毒用エタノール、70%イソプロパノール、イソプロパノール添加エタノール液)
・200~1,000ppm(0.02~0.1%)次亜塩素酸ナトリウム液
上記の方法はMRSA、VREなどを含む一般細菌、酵母菌に有効であり日常的な消毒法として十分であるが、その他特定の微生物を対象として消毒する必要がある場合には表Ⅲ-21の方法を選択する。
| 対象微生物 | 消毒薬と濃度 |
|---|---|
| インフルエンザウイルスなどエンベロープのあるウイルス 低水準消毒薬に抵抗性を示すグラム陰性菌(湿潤した表面) |
熱水(80℃ 10分間) アルコール 200~1,000ppm次亜塩素酸ナトリウム液注1) |
| HBVなど血中ウイルス (エンベロープあり) |
熱水(98℃ 6分間、多くの場合は80℃での10分間洗浄でも可) 1,000ppm次亜塩素酸ナトリウム液(血液自体の消毒は5,000~10,000ppm) アルコール |
| 糸状菌 | 熱水(80℃ 10分間) 500~1,000ppm次亜塩素酸ナトリウム液 アルコール |
| 結核菌 | 熱水(80℃ 10分間) アルコール 0.5~1%クレゾール石ケン液注2) 0.2~0.5%アルキルジアミノエチルグリシン塩酸塩液 1,000ppm以上の次亜塩素酸ナトリウム液(低濃度では無効) |
| ポリオウイルスなどエンベロープのないウイルス | 熱水(98℃ 15~20分間、多くの場合は80℃での10分間洗浄でも可) 500~1,000ppm(特別な場合には5,000ppm)次亜塩素酸ナトリウム液 場合によりアルコール |
| 芽胞 | 徹底的な洗浄・清拭 特別な場合には5,000ppm次亜塩素酸ナトリウム液 |
注1)次亜塩素酸ナトリウムをノンクリティカル器具・物品・環境の清拭に用いる場合には、原則としてごく小範囲に使用し広範囲には使用しない。
注2)クレゾール石ケン液は水質汚濁防止法、下水道法によりフェノール類として5ppmの排水中濃度規制があるため現在ではあまり用いられない。0.5~1%という濃度はクレゾールとしての濃度。
(文献114より転載)
聴診器は患者の皮膚や医療従事者の手指が頻繁に接触する器具であり、微生物の接触伝播が問題となる場合には、患者間の共用を避け、または患者間にまたがって使用する際にその先端部をアルコール系消毒薬で清拭して消毒する117)。血圧計のマンシェット(カフ)、松葉杖なども同様に扱い、適宜アルコール系消毒薬で清拭して消毒する。アルコールが使用できない器具の場合には、0.2%ベンザルコニウム塩化物液、0.2%ベンゼトニウム塩化物液、0.2%アルキルジアミノエチルグリシン塩酸塩液、または500ppm(0.05%)次亜塩素酸ナトリウム液で清拭して消毒する。
②ベッドパンなど
ベッドパンなど排泄物による汚染があるノンクリティカル器具は、フラッシャーディスインフェクター(ベッドパンウォッシャー)により、90℃1分間の蒸気による熱水消毒を行う。熱水消毒が行えない場合には、洗浄後に500ppm(0.05%)次亜塩素酸ナトリウム液に30分間浸漬する。下血、血便時などウイルスが問題となる場合には1,000ppm(0.1%)次亜塩素酸ナトリウム液に30分間浸漬する。また、赤痢菌や腸管出血性大腸菌、チフス菌・パラチフスA菌など細菌性胃腸炎患者に使用したベッドパンは洗浄後に0.1%ベンザルコニウム塩化物液、0.1%ベンゼトニウム塩化物液、0.1%アルキルジアミノエチルグリシン塩酸塩液に30分間浸漬する場合もある60)。
③水枕
水枕は布などにくるんで使用する場合がほとんどであり、清拭により汚れを落とし清潔に保管することで通常は十分である。
【聴診器などの消毒】
●消毒用エタノール
●70%イソプロピルアルコール
●イソプロパノール添加エタノール液
【ベッドパンの消毒】
熱水消毒が第一選択。熱水消毒が行えない場合には
●0.1%ベンザルコニウム塩化物液
●0.1%ベンゼトニウム塩化物液
●0.1%アルキルジアミノエチルグリシン塩酸塩液
●500ppm(0.05%)次亜塩素酸ナトリウム液
2)物品60、85、86、90、91、118)
本テキストにおいては、リネン、食器、浴槽、洗面台などを物品として分類し、その消毒法について述べる。一般にリネンや食器を経由した感染伝播が発生したとする報告は少ない。リネンや食器は通常でも洗剤と温水によって洗濯または洗浄され、十分な清浄化がなされた上で再利用されるからであると思われる。リネンや食器を経由した感染伝播の可能性が問題となる場合でも、耐熱性のものであるかぎり、熱水を用いて洗浄を行うことにより消毒を兼ねることが基本となる。日本においてはリネンと器具類の熱水消毒の基本条件として80℃ 10分間が勧告されている60、119、120)。リネンについて、CDCの2003年環境感染管理ガイドライン90、91)では71℃ 25分間が勧告され、英国においては65℃ 10分間または71℃ 3分間が勧告されている121)。英国においては別に器具類の熱水消毒の条件があり、それは71℃ 3分間、80℃ 1分間、または90℃ 12秒間である106)。一般に65~100℃の熱水による処理は感染が問題となるほとんどの微生物を死滅させることができる(表Ⅲ-22)。
| 国名 | リネン類 | 器具類 | ||
|---|---|---|---|---|
| 温度 | 時間 | 温度 | 時間 | |
| 日本 | 80℃ | 10分間 | 80℃ | 10分間 |
| 米国 | 71℃ | 25分間 | 基準なし | |
| 英国 | 65℃ | 10分間 | 71℃ | 3分間 |
| 71℃ | 3分間 | 80℃ | 1分間 | |
| 90℃ | 12秒間 | |||
| 食器 | ● 100~1,000ppm(0.01~0.1%)次亜塩素酸ナトリウム液 ● 消毒用エタノール |
|---|---|
| リネン | ● 100~1,000ppm(0.01~0.1%)次亜塩素酸ナトリウム液 ● 0.1~0.2%ベンザルコニウム塩化物液 ● 0.1~0.2%ベンゼトニウム塩化物液 ● 0.1~0.2%アルキルジアミノエチルグリシン塩酸塩液 |
| その他の物品 | ● アルコール系消毒薬(消毒用エタノール、70%イソプロパノール、イソプロパノール添加エタノール液) ● 100~1,000ppm(0.01~0.1%)次亜塩素酸ナトリウム液 ● 0.1~0.2%ベンザルコニウム塩化物液 ● 0.1~0.2%ベンゼトニウム塩化物液 ● 0.1~0.2%アルキルジアミノエチルグリシン塩酸塩液 |
(1)リネン
CDCの1985年ガイドライン66、67)は「使用済みのリネン類には病原性微生物が多数存在することが確認されているが、(通常の洗濯や衛生保管が行われているならば)実際の疾病伝播の危険性はとるに足らない程である。」と述べ、乾燥やアイロンがけによる加熱も微生物減少に効果があると説明した。その改定版である2003年環境感染管理ガイドラインも同様に90、91)、71℃25分間の熱水洗浄をする方法と熱水が使用できない場合には適切な化学洗剤などを用いる方法を勧告している。CDCの1996年隔離予防策ガイドライン85、86)においては「血液、体液、分泌物、排泄物で汚染されたリネンは皮膚や粘膜への曝露や衣服の汚染を防ぎ、ほかの患者や環境への微生物の伝播を避ける方法で処理、運搬する」と勧告されており、その改訂版である2007年改訂隔離予防策ガイドライン68、69)でも「空気や表面、人への汚染を避けるために使用した繊維類、布類はできるだけ振り動かさないよう取り扱う」と勧告されている。
日本の「消毒と滅菌のガイドライン」(2015年)60)も同様に、感染性のあるリネンは水溶性ランドリーバッグもしくはプラスチック袋に入れ感染性を明記して洗濯施設に運搬することとし、感染性のあるリネンの洗濯・消毒方法として表Ⅲ-24のものをあげている。また、洗濯の基本として表Ⅲ-25の事項が挙げられている。
| A | 80℃の熱水で10分間以上の洗濯処理を行う方法 |
|---|---|
| B | 次亜塩素酸ナトリウムなどの塩素系消毒薬を加えて洗濯を行う方法 例:B型肝炎ウイルスなどの汚染が考えられるリネンは、1,000ppm(0.1%)次亜塩素酸ナトリウム液に30分間浸漬する。その他の場合には200ppm(0.02%)に5分間以上浸漬する。 |
| C | その他の消毒薬を加える方法 例:塩素系消毒薬の漂白効果により影響を受けるリネンは、0.1%ベンザルコニウム塩化物液、0.1%ベンゼトニウム塩化物液または0.1%アルキルジアミノエチルグリシン塩酸塩液に30分間浸漬する。 |
| D | すすぎの段階で次亜塩素酸ナトリウムを使用する方法 例:100~200ppm(0.01~0.02%)次亜塩素酸ナトリウム液のすすぎ水に5分間浸漬する。 |
| A | 感染性の低いと考えられるものから洗濯する |
|---|---|
| B | 汚れの少ないものから洗濯する |
| C | 洗濯物の材質や汚れ具合に応じた洗濯時間、洗濯方法、使用洗剤、すすぎの回数などを工夫する |
| D | 漂白剤、酵素系洗剤など適当なものを選択する |
(2)食器など
CDCの2007年隔離予防策ガイドライン68、69)は「食器洗浄器で使われている熱水と洗剤の組み合わせは食器類や調理用具の汚染除去には十分である。それゆえ、食器類(皿、グラス、カップ)や調理用具について特別な予防策は必要ない。再利用する食器類や調理器具は感染経路別予防策を必要とする患者においても使用できるであろう。」と述べている。
日本の「消毒と滅菌のガイドライン」(2015年)60)と「大量調理施設衛生管理マニュアル」(2013年)122)において記述されている給食における消毒方法の要点は表Ⅲ-26、表Ⅲ-27のとおりである。食器洗浄器による熱水洗浄の通常条件は80℃ 10秒間である123)。熱水を使用できない場合には、200ppm(0.02%)次亜塩素酸ナトリウムに5分間以上浸漬する124)。
| A.食器の手による洗浄 | a.3槽のシンクを利用する b.第1槽の温水は50~55℃を確保する c.中性洗剤の濃度を規定どおりとする d.第2槽は洗剤を除去するため、40℃以上の温水が継続的に補給され、オーバーフローしていること e.第3槽は最終消毒用として熱水が77℃以上に保持され、90秒間以上浸漬する |
|---|---|
| B.食器の機械洗浄 | a.洗浄槽内は最低60℃を維持し、最終リンス温度は80~90℃とする b.コンベア型では洗浄速度を正確に保持する c.給湯ノズルの汚染に注意する |
| C.配膳カート、厨房設備の消毒 | 配膳カートの洗浄消毒は配膳の直前に行い、ベンザルコニウム塩化物、ベンゼトニウム塩化物またはアルキルジアミノエチルグリシン塩酸塩を使用して清拭消毒する。鍋、釜、包丁などのうち加熱可能なものは80℃以上10秒間以上の食器洗浄機による熱水洗浄をする。まな板は洗剤で洗浄後、熱水消毒または500ppm(0.05%)次亜塩素酸ナトリウム液で消毒する。ふきんは生乾き状態では細菌が急速に増殖するので、常に乾燥を心がける。消毒が必要な場合は、熱水消毒が効果的である。 |
表Ⅲ-27 「大量調理施設衛生管理マニュアル」(2013年)における器具等の洗浄・消毒方法122)
| A.調理機械 | ①.機械本体・部品を分解する。なお、分解した部品は 床にじか置きしないようにする。 ②.飲用適の水(40℃程度の微温水が望ましい。)で3回水洗いする。 ③.スポンジタワシに中性洗剤又は弱アルカリ性洗剤をつけてよく洗浄する。 ④.飲用適の水(40℃程度の微温水が望ましい。)でよく洗剤を洗い流す。 ⑤.部品は80℃で5分間以上又はこれと同等の効果を有する方法で消毒を行う。 ⑥.よく乾燥させる。 ⑦.機械本体・部品を組み立てる。 ⑧.作業開始前に70%アルコールで消毒またはこれと同等の効果を有する方法で消毒を行う。 |
|---|---|
| B.調理台 | ①.調理台周辺の片づけを行う。 ②.飲用適の水(40℃程度の微温水が望ましい。)で3回水洗いする。 ③.スポンジタワシに中性洗剤又は弱アルカリ性洗剤をつけてよく洗浄する。 ④.飲用適の水(40℃程度の微温水が望ましい。)でよく洗剤を洗い流す。 ⑤.よく乾燥させる。 ⑥.70%アルコールで消毒またはこれと同等の効果を有する方法で消毒を行う。 ⑦.作業開始前に⑥と同様の方法で消毒を行う。 |
| C.まな板、包丁、へら等 | ①.飲用適の水(40℃程度の微温水が望ましい)で3回水洗いする。 ②.スポンジタワシに中性洗剤又は弱アルカリ性洗剤をつけてよく洗浄する。 ③.飲用適の水(40℃程度の微温水が望ましい。)でよく洗剤を洗い流す。 ④.80℃で5分間以上又はこれと同等の効果を有する方法で殺菌を行う。 ⑤.よく乾燥させる。 ⑥.清潔な保管庫にて保管する。 |
| D.ふきん、タオル等 | ①.飲用適の水(40℃程度の微温水が望ましい。)で3回水洗いする。 ②.中性洗剤又は弱アルカリ性洗剤をつけてよく洗浄する。 ③.飲用適の水(40℃程度の微温水が望ましい。)でよく洗剤を洗い流す。 ④.100℃で5分間以上煮沸消毒を行う。 ⑤.清潔な場所で乾燥、保管する。 |
(3)その他の物品
その他の物品も感染伝播の経路として問題となる場合は限られている。浴槽や洗面台などを経由した感染伝播が問題となる場合には、0.2%ベンザルコニウム塩化物液、0.2%ベンゼトニウム塩化物液または0.2%アルキルジアミノエチルグリシン塩酸塩液で清拭して消毒し、熱水ですすぐ。洋式トイレの便座、フラッシュバルブ、水道ノブなどの消毒が必要な場合にはアルコール系消毒薬で清拭する。一般に常に湿潤している物品・環境においては緑膿菌やセラチアなどグラム陰性桿菌が増殖している場合があり、これらの細菌は低水準消毒薬に抵抗性を持つことがあるので、消毒が必要な場合には熱水、500ppm(0.05%)次亜塩素酸ナトリウム液、またはアルコール系消毒薬で中水準消毒を行うことが望ましい。血液などで汚染された場合には、汚染を拭き取った上、1,000ppm(0.1%)の次亜塩素酸ナトリウム液、場合によりアルコールで清拭する。
【Ⅲ-2-1)-(3)ノンクリティカル器具およびⅢ-2-3)-(2)ベッド周辺など を参照】
3)環境60、85~87、90、91、93、94、113、120)
感染対策において患者環境は、床・壁・天井など通常医療従事者や患者が直接接触することのない部分と床頭台など医療従事者や患者が頻繁に接触するベッド周辺などの部分とに分けて考える必要がある。
清掃不十分による塵埃の浮遊などがなければ、床などが感染の伝播に関与することはまれであり、血液が飛散するなどして高度の微生物汚染が発生しない限り消毒を行う必要はない。モップなどを用いた湿式清掃が日常的に行き届いていれば十分である。CDCの1985年ガイドラインは66、67)、「壁、床などの表面は通常微生物汚染があるものの、これら環境表面が患者や医療従事者への感染に関わることはまれである。したがってこれら環境表面を消毒したり、滅菌したりする必要はほとんどない。しかし日常的に汚れを取ることは推奨される。」と解説した。その改定版であるCDCの環境感染管理のガイドライン(2003年)90、91)や消毒と滅菌のためのガイドライン(2008年)93、94)は環境表面全般について、定期的に清掃すること、ならびに付着した汚物は直ちに清掃することを勧告した上で、汚れの内容が不明な場合や多剤耐性菌による汚染の恐れがある場合にはEPA承認の消毒薬入り洗浄剤注1)で清掃することを勧告した。
ここでいう消毒薬入り洗浄剤とはもっぱら低水準消毒を兼ねることのできる洗浄剤のことを指している。日本において市販されているものとしては、洗浄効果のある消毒薬であるベンザルコニウム塩化物、ベンゼトニウム塩化物などの第四級アンモニウム塩、アルキルジアミノエチルグリシン塩酸塩などの両性界面活性剤がここでいう消毒薬入り洗浄剤に相当する。これらの消毒薬入り洗浄剤を床などの環境用洗浄・殺菌剤として米国EPA(Environmental Protection Agency)が認可している。
また、従来は米国において、隔離予防策をとる必要のあった患者の環境に関しては、退院時に床も含めて消毒を行うことが勧告されていたが125)、その後の1996年隔離予防策ガイドラインは85、86)、「感染経路別予防策下にある患者の病室、個室やベッドサイドの器具は、感染微生物の存在と環境中の汚染量が特別の清掃を示唆しない限り、標準予防策下の患者で行われるのと同じ方法で清掃される。」と勧告し、隔離予防策下の患者についても通常は特別な環境消毒の必要性はないという立場を示しており、この考えは2007年に改定された隔離予防策ガイドライン68、69)においても変わっていない。CDCの1994年結核伝播予防ガイドライン126)およびその改定版(2005年)127、128)においても結核患者の環境表面が感染伝播に関与することはまれであり、特別な消毒は必要ないとしている。
特別な清浄度が必要とされる手術室においても、積極的な床の消毒は勧告されていない。CDCの1999年手術部位感染防止ガイドライン38、39)には、その日の最後の手術終了後、EPA承認の消毒薬入り洗浄剤を用いて手術室床面のウェット・バキューム(湿式吸引)清掃を行うことのみを勧告し、目に見える汚染がない限り手術と手術との間で壁や床などの環境表面あるいは使用した機器を消毒することは勧告されないとしている。また、手術室の入口などに消毒薬含有マット(ウェットマット)や粘着マットを設置しても、環境微生物の減少効果は少なく、また感染率の低下にも結びつかないと報告されているため、感染対策として手術部あるいは各手術室入口に粘着マットを設置しないと勧告している。
一方、易感染患者として極めて注意の必要な造血幹細胞移植患者の病室においても、手術室と同様、1日1回床を含む環境水平面を消毒薬入り洗浄剤で清掃することが勧告されているに過ぎない76、77)。
さて、これらCDCの諸ガイドラインにおいて、床も含めた環境表面全般にEPA承認の消毒薬入り洗浄剤を用いると勧告されている場合についてその根拠を調べると、床など頻繁に接触しない環境表面を消毒の対象に含めることによって医療関連感染が減少するというエビデンスに基づいて勧告されているわけではないことがわかる注2)。
クロストリジウム・ディフィシルによる集団感染時については、環境表面全般に次亜塩素酸ナトリウムを適用した時期に感染率の減少が観察された事例に基づいて、次亜塩素酸ナトリウムを環境に適用することがCDCにより勧告されている69、70、84、85)。ただし、クロストリジウム・ディフィシルの芽胞を消毒するには高濃度の次亜塩素酸ナトリウムが必要であり、金属腐食性などの問題を伴うため、広範囲の環境消毒に使用することはなるべく避けるべきである107)。
一方、床清掃に消毒薬を使用しても感染率に変化がないことを示した研究は複数存在する129~131)。したがってこれらのガイドラインは、頻繁に接触しない表面について、洗浄剤を用いて湿式清掃をする際に念のため低水準消毒薬入りのものを選択する場合があるという実務策を勧告しているに過ぎない。低水準消毒薬入り洗浄剤は安価であり、それを使用することにより特に安全性上の問題が生ずるわけでもなく、日頃洗浄剤を用いた湿式清掃がなされている場合には清掃作業を複雑化することにもならないため、そのようなかぎりにおいては現実的な方策のひとつと考えることもできる。ただし、日本における勧告は、様々なエビデンスを考慮した上で、一般病室、MRSA・VRE排菌患者の病室、手術室、造血幹細胞移植患者病室のすべてについて、床など頻繁に接触しない環境表面は1日1回の清掃、湿式清掃ないし洗浄剤を用いた湿式清掃を行うことのみを勧告し、血液などによる汚染がないかぎり消毒薬を用いる必要はないという原則を示している40、113、120)。
とはいえ、MRSAやVREなど長期間環境表面に生存し環境を経由した間接的な接触によっても伝播する微生物が問題となる場合には、頻繁に接触する表面に対する注意が必要である132)。前述の隔離予防策ガイドラインは、これらの病原体が感染または定着した患者が以前入っていた病室に入院してきた新しい患者は、ベッド周辺の器具、物品や環境表面(ベッド柵、床頭台、カート、ドアノブなど)が適切に清掃・消毒されていなければ、感染リスクが上昇することになると指摘している。したがって、MRSAやVREの感染症患者の病室では退院時に十分な清掃が必要であるとともに、医療従事者や患者の手が頻繁に接触する環境表面は最低1日1回清掃すべきである。この点については、洗浄剤を日常的に使用している場合は消毒薬入り洗浄剤を使用すべきであるという国際的コンセンサスも表明されている133)。また日本における勧告も113、120)、MRSAやVREを排菌している患者の病室では頻繁に接触する環境表面を低水準消毒薬ないしアルコールを用いて1日1回以上清掃することを勧告している。CDCの1995年バンコマイシン耐性菌伝播防止ガイドライン134、135)は「VREの伝播に環境が関係している可能性があるという報告があるので、VRE陽性患者が増え続けている施設は日常的に実施しているケア、清掃、ベッドサイドの環境表面の消毒などの手順が適切であり、かつ清掃担当者がこれらの清掃手順に従って実施していることを再度確認する」と勧告している。
環境整備は通常手作業で行うために、清掃・消毒をし損なう箇所ができることも考えられる。そのため、より確実な環境整備の方法として海外において蒸気化過酸化水素による環境消毒が行われている事例がある136~142)。蒸気化過酸化水素による環境消毒を行った期間と次亜塩素酸ナトリウムによる環境消毒を行った期間を比較して蒸気化過酸化水素を使用した期間のクロストリジウム・ディフィシル関連下痢症が有意に減少した報告142)もあり、注目すべき環境整備の方法の1つである。日本国内では臨床使用に向けた基礎的検討が行われている143~145)。この方法による環境消毒について経済効果などを含めた総合的評価を下すには十分なエビデンスが存在するとは未だ言えないが、今後、諸ガイドラインが改訂される可能性もある。
上記のように環境消毒が有用な場面もあるが、MRSAやVREなどの感染症患者が入院中に、環境表面を定期的に消毒することの意義は、あくまで補完的なものに過ぎない。なぜなら定期的に環境消毒を行っても短時間のうちにまた汚染されてしまうからである146)。したがって、このような環境消毒による対策を行っても、例えば患者周辺の環境に手を触れた場合には手洗いなど手指衛生を遵守するという基本的な対策の必要性と重大性を低下させるものではない。 また、環境の微生物検査については、医療関連感染の発生率が一般的に空気や環境表面の細菌汚染状況とは関係がなく、また環境表面における微生物汚染の許容基準がないという理由から、定期的な環境の細菌検査を行う必要はないとされている。CDCの2003年環境感染管理のガイドラインは90、91)、「医療機関において、空気、水、および環境表面のランダムで目的の不明確な微生物検査はするべきでない」と勧告している。
また手術室に関しても、CDCの1999年手術部位感染防止ガイドラインは日常的な環境微生物検査の必要はないとしている38、39)。環境の微生物検査が意味を持つのは何らかの感染症が施設内で多発したとき疫学的に環境が汚染源であると疑われた場合であり、日本の勧告もそのように述べており120)、CDCの2006年医療現場における多剤耐性菌対策のためのガイドラインでは環境が多剤耐性菌の伝播継続に関与している疫学的根拠があるならば環境培養を実施すると勧告している115、116)。その場合にはその特定の菌に焦点をあてて調査を行い、その結果に基づいてその後のしかるべき感染対策を立案し実施する。ただし、環境のある部分から問題となる微生物が検出されても、それが感染伝播の原因となる経路を示すものではなく、問題となるそのような微生物に感染した患者が存在したことの結果に過ぎない場合が多いので、その解釈は慎重に行う必要がある147)。
(1)床60、87)
床は定期的な清掃のほか、目に見える汚染が発生した場合や退院時に行う。壁やカーテンなどの垂直面は目に見える汚染が発生した場合に清掃・洗浄を行う。病室の床清掃はモップを使いほこりを立てないようにして湿式清掃を行うことが望ましい。具体的な方法としては1モップ2バケツ法、オフロケーション方式(表Ⅲ-28)などがある。通常は消毒薬を用いる必要がない。
| 1モップ2バケツ法 | バケツをすすぎ用と清拭用に分け、使ったモップをはじめにすすぎ、次に清拭用に浸してから、床を清拭する。 |
|---|---|
| オフロケーション方式 | 使用したモップは取り外し、新しいモップを清拭用バケツに浸して清掃していく(清拭用バケツに使用済みのモップを浸漬することがない)。 |
血液、体液などで床が汚染された場合には、それらを物理的に拭き取るなどして除去し1,000ppm(0.1%)次亜塩素酸ナトリウム液を用いて清拭消毒する。物理的な除去が行えない場合には、5,000~10,000ppm(0.5~1%)の次亜塩素酸ナトリウム液を用いる。
手術室などの床消毒や特別な場合に病室の床消毒を行う場合には、0.2%アルキルジアミノエチルグリシン塩酸塩液、0.2%ベンザルコニウム塩化物液または0.2%ベンゼトニウム塩化物液などの消毒薬を用い、ウェット・バキュームまたはモップを利用して湿式清掃を行う。血液、体液などで汚染がある場合には前記と同じように次亜塩素酸ナトリウムで汚染箇所のみを消毒する。
噴霧や散布の方法により消毒薬を広範囲の環境表面に用いることには、作業者に対する毒性の問題がある。また、噴霧は消毒薬と環境表面の十分な接触を確保するという点で不確実性が存在する。固定された装置の裏面など清拭することが不可能な部分に散布を行う場合を除き、消毒薬の噴霧や散布は行わないようにするべきである。特に、ホルマリン(ホルムアルデヒド)には発癌性があり、ホルマリン燻蒸は行うべきでない123)。
また、モップや布などによる場合であっても、グルタラールなど高水準消毒薬は毒性や刺激性を伴うため、環境表面に適用してはならない90、91、123)。日本においては以前、グルタラールの手術室適用が薬事法上承認されていたが、この適用は2003年7月に削除された。
【モップの消毒】
●1,000ppm(0.1%)次亜塩素酸ナトリウム液に30分間以上浸漬
【床の消毒】
●0.2%アルキルジアミノエチルグリシン塩酸塩液
●0.2%ベンザルコニウム塩化物液
●0.2%ベンゼトニウム塩化物液
血液・体液等で汚染がある場合
●物理的に除去し1,000ppm(0.1%)次亜塩素酸ナトリウム液で清拭
●5,000~10,000ppm(0.5~1%)次亜塩素酸ナトリウム液で清拭
(2)ベッド周辺など60、87)
ベッド枠、ベッドテーブル、床頭台、ドアノブ、カート、椅子、車椅子、ストレッチャー、点滴台支柱などの日常的清掃は清拭により行う。MRSAやVREなど接触により伝播する微生物を排菌している患者の場合には、医療従事者や患者が頻繁に接触するこれらの表面を1日1回以上低水準消毒薬またはアルコールを用いて清拭する。
低水準消毒薬を用いる場合には、0.2%ベンザルコニウム塩化物液、0.2%ベンゼトニウム塩化物液、または0.2%アルキルジアミノエチルグリシン塩酸塩液などの消毒薬で清拭する。また、人の手が頻繁に直接触れる部分についてはアルコール系消毒薬(消毒用エタノール、70%イソプロパノール、イソプロパノール添加エタノール液)で清拭するのが望ましい。ただしアルコールには可燃性があり、また塗装面を侵すこともあるので注意して使用し広範囲には用いない。接触伝播するウイルスなど特定の微生物を対象とする場合には、Ⅲ-2-1)-(3)ノンクリティカル器具の表Ⅲ-21にあるとおり消毒薬を選択する。血液、体液などで汚染がある場合には床の場合と同様に汚染を除去し、1,000ppm(0.1%)次亜塩素酸ナトリウム、場合によりアルコールで清拭する。また日本では薬事上の承認を受けていない雑品であるが、改良型塩素系製剤であるペルオキソ一硫酸水素カリウム製剤が国内で導入され医療機関において高頻度接触表面などの環境整備に使用されている。本剤の調製液は1,000ppmの次亜塩素酸ナトリウムと同等の酸化力を有しており、米国の環境保護庁(EPA)では消毒薬に抵抗性の強いノロウイルスをはじめ、MRSAやVRE、B型・C型肝炎ウイルスなどにも適用可能な製剤として複数のリストに登録されている148)。
また、医療機器の表面やコンピューターキーボードなど 1)頻繁に接触するもの、2)血液・体液などで汚染されやすいもの、3)清拭の困難なものはドレープなどカバーをかけ90、91)、そのカバーを定期的に洗浄・清拭し必要に応じて消毒する。
以上のことをまとめると表Ⅲ-29のようになる。
| 医療機器表面 | バリアプリコーション (清拭、あらかじめドレープなどでカバー) |
||
|---|---|---|---|
| ハウスキーピング表面 (環境表面) |
頻繁に手が触れる表面 | ドアノブ、ベッド柵、床頭台テーブル | 一日一回以上の清拭、消毒 |
| ほとんど手が触れない表面 | 水平面 (病室の床など) |
定期清掃 汚染時清掃 退院時清掃 |
|
| 垂直面 (壁、カーテンなど) |
汚染時清掃・洗浄 | ||
米国の慢性血液透析患者における感染予防のためのガイドライン(2001)の原文では、ノンクリティカル器具の透析患者間での消毒には低水準消毒薬、ただし血液汚染がある場合には中水準消毒薬(または殺結核菌消毒薬)を用いると記載されているが、これは米国で市販されている低水準・中水準消毒薬の中にはHIVまたはHBVに有効と表示することが認可されている配合剤が数多くあるためと思われる。日本においては、血中ウイルスに対する消毒薬の効果をより厳密にとらえることが一般的であるので、血中ウイルスの消毒にはアルコール系消毒薬または次亜塩素酸系消毒薬を選択することが妥当である。
| A | 患者ケアや患者の備品に触れるときには常時手袋を着用する |
|---|---|
| B | 手袋をはずした後や患者間では手洗い(温水と石けんまたは速乾性手指消毒薬による)をする |
| C | 透析ステーションに持ち込まれた物品は、使い捨てもしくは1人の患者のみに使用する |
| D | 持ち込んだ物品を共通の清潔区域に戻したり、他の患者に使用する前には洗浄および消毒を行う |
| E | 個々の患者治療の後にはベッド周辺の環境表面を石けん、洗浄剤、消毒薬入り洗浄剤を用いて清掃する |
| F | 患者間でノンクリティカル器具を共用する場合には、消毒薬を使用して清浄化すること。血液が付着している場合には次亜塩素酸ナトリウムなどを使用して清浄化する |
●0.2%アルキルジアミノエチルグリシン塩酸塩液
●0.2%ベンザルコニウム塩化物液
●0.2%ベンゼトニウム塩化物液
●消毒用エタノール
●70%イソプロパノール
●イソプロパノール添加エタノール液

